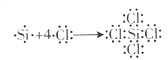题目内容
2005年12月2日新浪网报道,我国独立研制的具有自主知识产权的“龙芯2D”12月底完成流片.“龙芯2D”的面世,意味着中国在半导体产业上已取得了长足进步,同时将有着良好的发展前景.试回答下列问题:
(1)“龙芯”(芯片)的主要成分是单晶硅,硅位于元素周期表中第______周期______族;
(2)硅在一定条件下可以与氯气反应生成SiCl4,与氧气反应生成SiO2.四氯化硅结构中,所有原子最外层______(填“是、否”)都满足8电子稳定结构.用电子式表示四氯化硅的形成过程:
______.
(3)试判断SiCl4的沸点比CCl4的______(填“高或低”),理由______
(4)现在新开发出一种具有和“龙芯”主要成分一样的六角形笼状结构单质分子Si12,它可能在未来的量子计算机中是一个理想的贮存信息的材料,是种六角形笼状结构:它与单晶硅互称为______,硅原子之间是通过______键结合的.
解:(1)硅的原子结构示意图为: ,所以硅位于元素周期表中第3周期ⅣA族,故答案为:3;ⅣA;
,所以硅位于元素周期表中第3周期ⅣA族,故答案为:3;ⅣA;
(2)因四氯化硅的电子式为: ,所有原子最外层都满足8电子稳定结构;用电子式表示四氯化硅的形成过程为:
,所有原子最外层都满足8电子稳定结构;用电子式表示四氯化硅的形成过程为: ,
,
故答案为:是;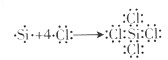 ;
;
(3)分子组成和结构相似的分子,相对分子质量越大,物质的熔沸越大,所以SiCl4的沸点比CCl4的高,
故答案为:高;SiCl4的相对分子质量比CCl4的大,范德华力大,因此沸点高;
(4)因单晶硅与Si12都是由硅元素形成的不同单质,故互称为同素异形体,硅与硅之间形成的是共价键,故答案为:同素异形体;共价.
分析:(1)根据硅的原子结构示意图来判断;
(2)根据四氯化硅的电子式来判断;根据用电子式表示共价化合物的形成过程;
(3)根据分子组成和结构相似的分子,相对分子质量越大,物质的熔沸越大;
(4)根据同素异形体的概念及同种元素之间的成键来判断.
点评:本题主要考查了元素周期律的知识,难度不大,根据课本知识即可完成.
 ,所以硅位于元素周期表中第3周期ⅣA族,故答案为:3;ⅣA;
,所以硅位于元素周期表中第3周期ⅣA族,故答案为:3;ⅣA;(2)因四氯化硅的电子式为:
 ,所有原子最外层都满足8电子稳定结构;用电子式表示四氯化硅的形成过程为:
,所有原子最外层都满足8电子稳定结构;用电子式表示四氯化硅的形成过程为: ,
,故答案为:是;
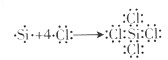 ;
;(3)分子组成和结构相似的分子,相对分子质量越大,物质的熔沸越大,所以SiCl4的沸点比CCl4的高,
故答案为:高;SiCl4的相对分子质量比CCl4的大,范德华力大,因此沸点高;
(4)因单晶硅与Si12都是由硅元素形成的不同单质,故互称为同素异形体,硅与硅之间形成的是共价键,故答案为:同素异形体;共价.
分析:(1)根据硅的原子结构示意图来判断;
(2)根据四氯化硅的电子式来判断;根据用电子式表示共价化合物的形成过程;
(3)根据分子组成和结构相似的分子,相对分子质量越大,物质的熔沸越大;
(4)根据同素异形体的概念及同种元素之间的成键来判断.
点评:本题主要考查了元素周期律的知识,难度不大,根据课本知识即可完成.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目