题目内容
利用下列实验装置进行的相应实验,不能达到实验目的的是
| A.图1所示装置可制取氨气 |
| B.图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.图3所示装置可制取乙烯并验证其易被氧化 |
| D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
B
解析试题分析:A、可用浓氨水和生石灰来制取氨气,正确;B、乙醇与乙酸乙酯二者互溶,不能用分液漏斗分离,错误;C、乙醇和浓硫酸共热过程中会产生乙烯、二氧化硫、乙醚等物质。前两者均可使酸性高锰酸钾溶液褪色,在进入酸性高锰酸钾溶液之前用碱液除去二氧化硫,即可验证乙烯被氧化,正确;D、浓硫酸使蔗糖变黑说明浓硫酸具有脱水性,产生使品红溶液褪色的气体说明浓硫酸具有强氧化性,同时也证明二氧化硫的漂白性,使酸性高锰酸钾溶液褪色说明二氧化硫具有还原性,正确,答案选B。
考点:考查对化学实验装置正确使用的判断

练习册系列答案
相关题目
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是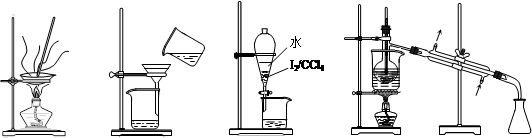
| A.灼烧 | B.过滤 | C.分液 | D.蒸馏 |
下列有关实验装置进行的相应实验,能达到实验目的的是
| A.用图l装置完成实验室制取乙酸乙酯 |
| B.用图2所示装置可制取大量的CO2气体 |
| C.用图3所示装置可分离溴的四氯化碳溶液和水 |
| D.用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
下列根据实验操作和现象所得出的结论错误的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X不一定含有SO42- |
| B | 向FeCl3+3KSCN Fe(SCN)3+3KCl溶液平衡体系中加入少量固体KCl Fe(SCN)3+3KCl溶液平衡体系中加入少量固体KCl | 体系颜色无变化] | KCl不能使该平衡移动 |
| C | 向浓度均为0. 1 mol·L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验: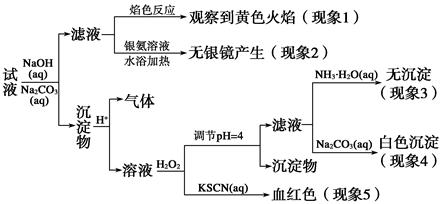
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是 ( )。
| A.根据现象1可推出该试液中含有Na+ |
| B.根据现象2可推出该试液中并不含有葡萄糖酸根 |
| C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ |
| D.根据现象5可推出该试液中一定含有Fe2+ |
下列关于离子检验的说法中,正确的是( )
| A.向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液一定含有CO32— |
| B.向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl- |
| C.向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42— |
| D.通入Cl2后,溶液变为黄色,加淀粉液后变蓝,则原溶液中一定有I- |
利用下列实验装置能完成相应实验的是( )
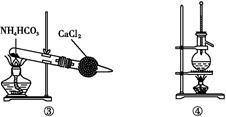
| A.装置①测定化学反应速率 |
| B.装置②制取并吸收HCl |
| C.装置③制备纯净的NH3 |
| D.装置④可用于分离沸点相差较大的互溶液体混合物 |
下列操作正确的是( )
| A.只有② | B.②③ | C.③④ | D.全部错误 |
某溶液仅含Fe2+、Na+、Al3+、Ba2+、S 、N
、N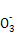 、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
| A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72 g |
| B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 |
| C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |