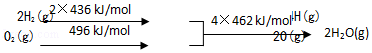
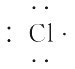题目内容
【题目】现有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为 ![]() ,B原子L层的电子数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变得与氖原子相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
,B原子L层的电子数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变得与氖原子相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出元素A、B、C、D的名称:
A. , B. , C. ,
D.。
(2)D元素在元素周期表中位于第周期第族。
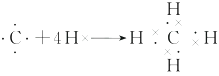
(3)用电子式表示A的气态氢化物的形成过程:。
(4)A和B的单质充分反应生成化合物的结构式是。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?
【答案】
(1)碳;氧;镁;铝
(2)三;ⅢA
(3)
(4)![]()
(5)B与C形成的化合物是MgO,为离子化合物。
检验方法:验证其熔融状态是否导电,若导电则为离子化合物,若不导电则为共价化合物。(其他合理答案也可)
【解析】 由A的电子式可知,A为碳或硅,又因为B原子L层的电子数是K层的3倍,所以B为氧,A、B在同一周期且原子序数依次增大,则A为碳;0.1 mol C可从酸中置换出0.1 mol H2 , 则C为能形成+2价化合物的金属,故为镁;根据D离子的电子层结构及离子半径可知D为铝。
根据元素在元素周期表的性质,递变规律,位置推算出元素名称,再由已知元素的性质解答问题。

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目