题目内容
【题目】CO2、CS2、COS是由C、O、S三种元素形成的结构相似的化合物。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是_____________(填序号)
A.亚硫酸溶液加入Na2CO3溶液中,产生气泡
B.氧化性:浓H2SO4>H2CO3
C.CS2中碳元素为+4价,硫元素为—2价
D.SO2有较强还原性,而CO2无还原性
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。
① 羰基硫的结构式为:________________。沸点:CO2_________COS(填“大于”或“小于”),说明原因_____________________。
②下列有关羰基硫的推测肯定不正确的是_________________
A.COS分子中,所有原子都满足8电子的稳定结构
B.COS分子是含有极性键的非极性分子
C.COS分子中三个原子处于同一直线上
D.COS可能在O2中燃烧
③ 羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下图:

已知A是一种盐,则A的化学式为________;气体单质a为____________________.
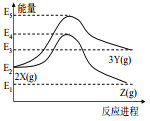
(3)在恒容密闭容器中,CO和H2S混合加热生成羰基硫的反应为CO(g)+H2S(g)![]() COS(g)+H2(g),反应前CO和H2S的物质的量均为10mol,平衡后CO的物质的量为8mol,回答下列问题:
COS(g)+H2(g),反应前CO和H2S的物质的量均为10mol,平衡后CO的物质的量为8mol,回答下列问题:
①升高温度,H2S浓度增加,表明该反应是__________________反应(填“放热”或“吸热”)。
②平衡时,继续通入CO10mol和H2S10mol,一段时间后再次达到平衡,此时H2S的转化率_____(填“增大”“减小”或“不变”)
(4)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是____________
A.容器内气体密度保持不变
B.CO、H2S、COS、H2的浓度均不再变化
C.c(H2)=c(H2S)
D.v(H2)正=v(H2S)逆
【答案】(1)c;(2)①O=C=S ;小于 ;均为分子晶体,结构组成相似,相对分子质量增加,熔沸点升高;且COS为极性分子,CO2为非极性分子,极性分子熔沸点高于非极性分子
②B ;③Na2CO3;H2;
(3)放热;不变;(4)B、D。
【解析】(1)A.亚硫酸溶液加入Na2CO3溶液中,产生气泡,证明反应产生CO2,说明酸性H2SO3>H2CO3,由于H2SO3不是S元素的最高化合价含氧酸,因此不能证明元素的非金属性S>C,错误;B.元素最高价氧化物对应水化物的氧化性强弱与物质分子结构有关,与元素的非金属性强弱无关,错误;C.CS2是共价化合物,共用电子对偏向吸引电子能力强的元素,吸引电子能力强的元素显负价,吸引电子能力弱的元素表现正化合价,在CS2中碳元素为+4价,硫元素为-2价,可以证明元素的非金属性S>C,正确; D.SO2中S元素的化合价处于S元素的中间价态,可以失去电子,表现较强还原性,而CO2中C元素为其最高化合价,只有弱氧化性,无还原性,则与元素的非金属性强弱无关,错误。(2)① 羰基硫COS是CO2分子中的O原子被S原子代替产生的,由于O、S是同一主族的元素,原子结构相似,所以可知COS的结构式为:O=C=S。二者都是分子晶体,由于分子间作用力COS> CO2,所以二者的沸点比较:CO2<COS;②A.COS分子中,C原子与O、S原子分别形成2对共用电子,从而使分子中所有原子都满足8电子的稳定结构,正确;B.COS分子是含有极性键的极性分子,错误;C.COS分子中三个原子处于同一直线上,键角是180°,正确;D.COS可能在O2中燃烧,反应产生CO2、SO2,正确;③由图示可知生成正盐为Na2S,由元素守恒可知,生成正盐还有Na2CO3,反应为COS+4NaOH= Na2S+Na2CO3 +2H2O,硫化钠与水反应生成S2O32-、氢气和氢氧化钠,其反应的离子方程式为:2S2-+ 5H2O![]() S2O32-+4H2↑+2OH-,所以A的化学式为Na2CO3,气体单质a为H2;(3)①升高温度,H2S浓度增加,表明升高温度,化学平衡向逆反应方向移动。由于升高温度化学平衡向吸热反应方向移动,逆反应是吸热反应,所以该反应正反应是放热反应;②由于该反应是反应前后气体体积不变的反应,所以继续通入CO10mol和H2S10mol,即增大压强,一段时间后再次达到平衡,化学平衡不发生移动,此时H2S的转化率不变;(4)A.该反应的反应混合物都是气体,由于容器的容积不变,所以在任何时刻容器内气体密度保持不变,不能判断反应是否为平衡状态,错误; B.CO、H2S、COS、H2的浓度均不再变化,则反应达到平衡状态,正确;C.c(H2)=c(H2S),反应可能处于平衡状态,也可能未达到平衡,这与反应开始的条件及加入反应物的多少有关,错误; D.v(H2)正=v(H2S)逆,则用同一物质表示的化学反应正反应速率和逆反应速率相等,反应处于平衡状态,正确。
S2O32-+4H2↑+2OH-,所以A的化学式为Na2CO3,气体单质a为H2;(3)①升高温度,H2S浓度增加,表明升高温度,化学平衡向逆反应方向移动。由于升高温度化学平衡向吸热反应方向移动,逆反应是吸热反应,所以该反应正反应是放热反应;②由于该反应是反应前后气体体积不变的反应,所以继续通入CO10mol和H2S10mol,即增大压强,一段时间后再次达到平衡,化学平衡不发生移动,此时H2S的转化率不变;(4)A.该反应的反应混合物都是气体,由于容器的容积不变,所以在任何时刻容器内气体密度保持不变,不能判断反应是否为平衡状态,错误; B.CO、H2S、COS、H2的浓度均不再变化,则反应达到平衡状态,正确;C.c(H2)=c(H2S),反应可能处于平衡状态,也可能未达到平衡,这与反应开始的条件及加入反应物的多少有关,错误; D.v(H2)正=v(H2S)逆,则用同一物质表示的化学反应正反应速率和逆反应速率相等,反应处于平衡状态,正确。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案