题目内容
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
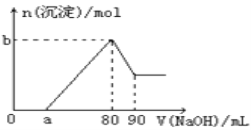
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
【答案】C
【解析】
根据图像可知开始阶段没有沉淀,说明反应后盐酸过量,首先发生中和反应,然后开始沉淀镁离子、铝离子,最后氢氧化钠溶解氢氧化铝,剩余的沉淀是氢氧化镁,据此解答。
A、第一阶段,盐酸和氢氧化钠反应:H++OH-=H2O;第二阶段,氯化镁、氯化铝和氢氧化钠反应:Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,在V(NaOH)=80mL时,溶液中溶质全为NaCl,由于盐酸和氢氧化钠的浓度相等,所以盐酸的体积为80mL,故A正确;
B、第三阶段,氢氧化铝溶解:Al(OH)3+NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol,和Al3+反应的NaOH为30mL,因为第一阶段和Al3+反应的NaOH为30mL,假设无Mg2+,a=50,而实际存在Mg2+,所以0<a<50,故B正确;
C、a=30时,和Mg2+反应的NaOH为20mL,此时n(Mg2+)=0.01mol,b=n(Mg2+)+n(Al3+)=0.02mol,故C错误。
D、第三阶段,氢氧化铝溶解:Al(OH)3+NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol,第四阶段无反应,沉淀全为Mg(OH)2,若a=0,n(Mg2+)取得最大值。第一阶段,和Al3+反应的NaOH为30mL,所以此时和Mg2+反应的NaOH为50mL,即镁离子的最大值为0.025mol,而如图所示a>0,所以n(Mg2+)<0.025mol,故D正确;
故答案选C。