题目内容
【题目】用方铅矿精矿(主要为PbS)和软锰矿(主要为MnO2,还有少量Fe2O3,Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:

已知:①PbS+MnO2+4H+=Mn2++Pb2++S+2H2O
②25℃时,Ksp(PbCl2)=1.6×10-5,Ksp(PbSO4)=1.8×10-8
③PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)△H>0
PbCl42-(aq)△H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_________________;加入物质X可用于调节酸浸液的pH值,物质X可以是___________(填字母)。
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有两种金属杂质形成的化合物,其成分为_____________(写化学式);
请设计分离两种金属化合物的路线图(用化学式表示物质,用箭头表示转化关系,箭头上注明试剂和分离方法)。______________________________________
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式。___________________________________
(5)用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为___________(填字母)。
A.热还原法 B.电解法 C.热分解法
(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应的平衡常数K=___________(保留到整数位)。
【答案】 粉碎矿石或搅拌或适当增加盐酸浓度 增大PbCl2的溶解度 AD Al(OH)3、Fe(OH)3  6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+ A 889
6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+ A 889
【解析】(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是粉碎矿石或搅拌或适当增加盐酸浓度;(2)由于PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),向酸浸液中加入饱和食盐水,溶液中氯离子浓度较大,可使平衡正向移动,增大PbCl2的溶解度;加入物质X可用于调节酸浸液的pH值,选项中各物质均能消耗氢离子起调节pH,但选用氢氧化钠溶液会溶解氢氧化铝,产生干扰离子偏铝酸根离子,选用氧化锌会引入新杂质,故物质X可以是AD;(3)根据软锰矿中还有少量Fe2O3,Al2O3等杂质,制备过程中必须除杂,故滤渣中含有两种金属杂质形成的化合物的成分为Al(OH)3、Fe(OH)3;分离两种金属化合物可利用氢氧化铝为两性氢氧化物利用强碱溶解后过滤,再利用二氧化碳将偏铝酸盐处理得到氢氧化铝,流程如下:
PbCl42-(aq),向酸浸液中加入饱和食盐水,溶液中氯离子浓度较大,可使平衡正向移动,增大PbCl2的溶解度;加入物质X可用于调节酸浸液的pH值,选项中各物质均能消耗氢离子起调节pH,但选用氢氧化钠溶液会溶解氢氧化铝,产生干扰离子偏铝酸根离子,选用氧化锌会引入新杂质,故物质X可以是AD;(3)根据软锰矿中还有少量Fe2O3,Al2O3等杂质,制备过程中必须除杂,故滤渣中含有两种金属杂质形成的化合物的成分为Al(OH)3、Fe(OH)3;分离两种金属化合物可利用氢氧化铝为两性氢氧化物利用强碱溶解后过滤,再利用二氧化碳将偏铝酸盐处理得到氢氧化铝,流程如下: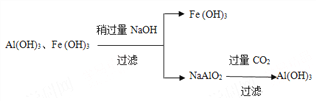 ;(4)向滤液2中通入NH3和O2发生反应生成Mn3O4,总反应的离子方程式为6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+;(5)根据金属活动顺序,用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为热还原法,答案选A;(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应PbCl2(s)+SO42-(aq)
;(4)向滤液2中通入NH3和O2发生反应生成Mn3O4,总反应的离子方程式为6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+;(5)根据金属活动顺序,用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为热还原法,答案选A;(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应PbCl2(s)+SO42-(aq)![]() 2Cl-(aq)+PbSO4(s)的平衡常数K=
2Cl-(aq)+PbSO4(s)的平衡常数K=![]() =
=![]() 。
。

 计算高手系列答案
计算高手系列答案【题目】甲醇可采用多种方法制备,其用途广泛,是重要的化工原料。
Ⅰ.利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,发生反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)反应①过程中能量变化如下图所示,下列说法正确的是______________(填选项标号)。

A.①反应的△H=逆反应活化能-正反应活化能
B.把1molCO(g)和2molH2(g)充入密闭容器中充分反应,达平衡时放出的热量为91kJ
C.从图中信息可知加入催化剂能改变反应历程和热效应
D.相同条件下,CO(g)和H2(g)反应生成1mol液态CH3OH放出的热量大于91kJ
(2)现利用①和②两个反应合成CH3OH,已知CO可使反应的催化剂寿命下降。
若氢碳比表示为f= [(n(H2)-n(CO2)]/[(n(CO)-n(CO2)],则理论上f=______________时,原料气的利用率最高。但生产中往往采用略高于该值的氢碳比,理由是:______________________________。
Ⅱ.甲醇可用于制取甲酸甲酯,其反应方程式为:CH3OH(g)+CO(g)![]() HCOOCH3(g)△H<0。科研人员的部分研究结果如下:
HCOOCH3(g)△H<0。科研人员的部分研究结果如下:

(3)从反应压强对甲醇转化率的影响“效率”图和生产成本角度分析,工业制取甲酸甲酯应选择的最佳压强是______________________(填“3.5×106Pa”“4.0×106Pa”或“5.0×106Pa”)。
(4)实际工业生产中采用的温度是80℃,其理由是_______________________________________。
Ⅲ.甲醇还可以用于合成二甲醚,发生的反应为2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
己知该反应在某温度下的平衡常数为900,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度(mol/L) | 1.25 | 0.9 | 0.9 |
(5)比较此时正、逆反应速率的大小:v正___________v逆(填“>“<”或“=”)。
(6)若加入CH3OH后,经6min反应达到平衡,则该时间内平均反应速率v(CH3OH)=___________mol/(L·min)。





