题目内容
如右图所示将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2 mol。若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,回答下列问题:
2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2 mol。若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,回答下列问题:
 ⑴ 在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数__减小__(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有: 或 。
⑴ 在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数__减小__(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有: 或 。
⑵ 若起始时a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时c的取值为 。
⑶ 若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是 。
⑴ 减小__, 升温 或 减压 。
⑵ 任意值 。
⑶ 3.6<c≤4 。

练习册系列答案
相关题目
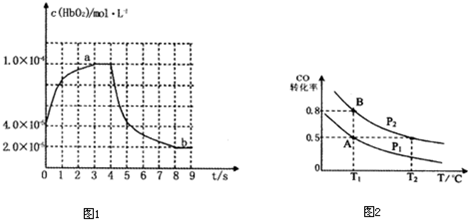
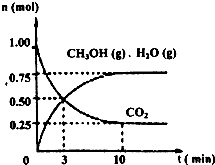 2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.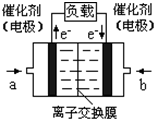 意图,则a处通入的是
意图,则a处通入的是