题目内容
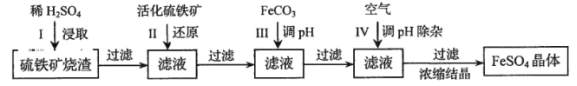
【题目】如图所示,下列叙述正确的是( )
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
【答案】A
【解析】
试题分析:装置的左侧Zn与Cu构成原电池,Zn作原电池的负极,Cu作原电池的正极。整个装置是以原电池为电源的电解装置,Y连接原电池的负极,为电解池的阴极,发生还原反应,电极反应式为:2H++2e-=H2↑,且Y与滤纸接触处变红;X与原电池的正极相连,为电解池的阳极,发生氧化反应,电极反应式为:2H2O-4e-=4H++O2↑。A.由以上分析可知,Y为阴极,发生还原反应,A正确;B.X为阳极,发生氧化反应,B错误;C.Y与滤纸接触处有氢气生成,且变红,C错误;D.X与滤纸接触处不变红,D错误。故答案A。

练习册系列答案
相关题目