��Ŀ����
����Ŀ����1����ͭ��(Cu2S)�ɷ�����Ӧ��2Cu2S��2H2SO4��5O2===4CuSO4��2H2O���÷�Ӧ�Ļ�ԭ����________________����1 mol O2������Ӧʱ����ԭ����ʧ���ӵ����ʵ���Ϊ_________mol��
��2�����������Ļ�ѧ����ʽΪ4KAl(SO4)2��12H2O��3S===2K2SO4��2Al2O3��9SO2��48H2O���ڸ÷�Ӧ�У���ԭ����_____________��
(3)KClO3������ʵ������O2�������Ӵ�����400��ʱ�ֽ�ֻ���������Σ�����һ�����������Σ���һ���ε��������Ӹ�����Ϊ1��1��д���÷�Ӧ�Ļ�ѧ����ʽ��________________________��
��4��ʵ���ҴӺ����Һ(��H2O�⣬����CCl4��I2��I����)�л��յ⣬��ʵ��������£�
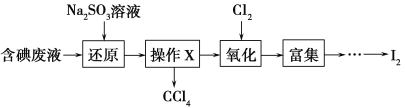
���Һ�м����Թ�����Na2SO3��Һ������Һ�е�I2��ԭΪI���������ӷ���ʽΪ_________________���ò�����I2��ԭΪI����Ŀ����________________________��
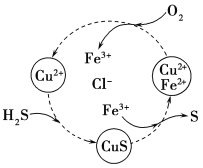
��5����H2S�Ϳ����Ļ������ͨ��FeCl3��FeCl2��CuCl2�Ļ����Һ�з�Ӧ����S��������ת����ͼ��ʾ����ͼʾ��ת���У����ϼ۲����Ԫ����________________��
��6��NaBH4��һ����Ҫ�Ĵ������壬����ˮ��Ӧ�õ�NaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬�÷�Ӧ�Ļ�ѧ����ʽΪ________________����Ӧ����1 mol NaBH4ʱת�Ƶĵ�����ĿΪ_____________��
���𰸡���1��Cu2S 4��2��S��
��3��4KClO3![]() KCl��3KClO4
KCl��3KClO4
��4��SO![]() ��I2��H2O===2I����SO
��I2��H2O===2I����SO![]() ��2H�� ʹCCl4�еĵ����ˮ��
��2H�� ʹCCl4�еĵ����ˮ��
��5��Cu��H��Cl(��ͭ���⡢��)
��6��NaBH4��2H2O===NaBO2��4H2�� 4NA��2.408��1024
��������
�����������1���ڸ÷�Ӧ�У�Cu2S�е�CuԪ�ػ��ϼ����ߣ���������Cu2SΪ��ԭ����O2�е���Ԫ�ػ��ϼ۽��ͣ�����ԭ��O2Ϊ����������1 mol O2������Ӧʱ���������õ����ӵ����ʵ���Ϊ4mol�����ڵ�ʧ�����غ㣬��˻�ԭ��ʧȥ���ӵ����ʵ���ҲΪ4mol����2�����������ķ�Ӧ�У���Ԫ�صĻ��ϼۼ����ߣ��ֽ��ͣ����S�������������ǻ�ԭ������3��KClO3������ʵ������O2�������Ӵ�����400��ʱ�ֽ�ֻ���������Σ�����һ�����������Σ���ΪKCl��������KCl�Ĺ����У���Ԫ�ػ��ϼ۽��ͣ������������һ���εĹ����У���Ԫ�ػ��ϼ����ߣ��Ҹ��ε��������Ӹ�����Ϊ1��1����ΪKClO4����˷�Ӧ�Ļ�ѧ����ʽΪ4KClO3![]() KCl��3KClO4����4�������Һ�м����Թ�����Na2SO3��Һ������Һ�е�I2��ԭΪI������Ӧ�����ӷ���ʽΪSO
KCl��3KClO4����4�������Һ�м����Թ�����Na2SO3��Һ������Һ�е�I2��ԭΪI������Ӧ�����ӷ���ʽΪSO![]() ��I2��H2O===2I����SO
��I2��H2O===2I����SO![]() ��2H�����ò�����I2��ԭΪI����Ŀ����ʹCCl4�еĵ����ˮ�㣻��5����������ת����ͼʾ��֪�����ϼ۲����Ԫ����Cu��H��Cl����6��NaBH4��һ����Ҫ�Ĵ������壬����ˮ��Ӧ�õ�NaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬��NaBH4��HԪ�ػ��ϼ�Ϊ-1�ۣ�NaBH4��H2O��Ӧʱ��NaBH4�е���Ԫ�ػ��ϼ����ߣ�������ΪH2��NaBH4����ԭ����H2O�е���Ԫ�ػ��ϼ۽��ͣ�����ԭΪH2��H2O����������H2���ǻ�ԭ�����������������Ӧ�Ļ�ѧ����ʽΪNaBH4��2H2O===NaBO2��4H2������Ӧ����1 mol NaBH4ʱת�Ƶĵ�����ĿΪ4NA��
��2H�����ò�����I2��ԭΪI����Ŀ����ʹCCl4�еĵ����ˮ�㣻��5����������ת����ͼʾ��֪�����ϼ۲����Ԫ����Cu��H��Cl����6��NaBH4��һ����Ҫ�Ĵ������壬����ˮ��Ӧ�õ�NaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬��NaBH4��HԪ�ػ��ϼ�Ϊ-1�ۣ�NaBH4��H2O��Ӧʱ��NaBH4�е���Ԫ�ػ��ϼ����ߣ�������ΪH2��NaBH4����ԭ����H2O�е���Ԫ�ػ��ϼ۽��ͣ�����ԭΪH2��H2O����������H2���ǻ�ԭ�����������������Ӧ�Ļ�ѧ����ʽΪNaBH4��2H2O===NaBO2��4H2������Ӧ����1 mol NaBH4ʱת�Ƶĵ�����ĿΪ4NA��

