题目内容
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 1 mol氢氧化铁胶粒所含氢氧化铁的分子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 足量的Fe和1mol Cl2完全反应,转移的电子数为3NA |
分析 A、H218O与D2O的摩尔质量均为20g/mol,且均含10个中子;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、过氧化钠与二氧化碳的反应为歧化反应,1mol二氧化碳参与反应时,反应转移1mol电子;
D、根据反应后氯元素为-1价来分析.
解答 解:A、H218O与D2O的摩尔质量均为20g/mol,故2.0g混合物的物质的量为0.1mol,且两者均含10个中子,故0.1mol混合物中含1mol中子即NA个,故A正确;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol胶粒中含的氢氧化铁分子的个数多于NA个,故B错误;
C、过氧化钠与二氧化碳的反应为歧化反应,1mol二氧化碳参与反应时,反应转移1mol电子,故标况下5.6L二氧化碳的物质的量为0.25mol参与反应时,转移0.25mol电子即0.25NA个,故C错误;
D、由于反应后氯元素为-1价,故1mol氯气转移2mol电子即2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.下列说法中,正确的是( )
| A. | 煤的气化是物理变化 | |
| B. | 石油裂解的主要目的是为了得到更多的汽油 | |
| C. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| D. | 煤干馏得到的煤焦油中有芳香烃 |
19.实验测定NaHCO3溶液显碱性,下列说法中正确的是( )
| A. | 在水溶液中,HCO3-仅仅发生水解 | |
| B. | 在水溶液中,HCO3-仅仅发生电离 | |
| C. | 在水溶液中,HCO3-的水解程度要大于电离程度 | |
| D. | 在水溶液中,HCO3-的电离程度要大于水解程度 |
16.含一个双键的烯烃,与氢气加成后的产物结构简式如图,此烯烃可能有的结构有( )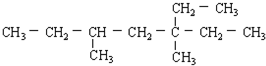
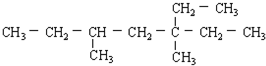
| A. | 1种 | B. | 3种 | C. | 5种 | D. | 7种 |
3.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1 mol CO2、CO的混合气中含有的氧原子数为1.5NA | |
| B. | 常温常压下,11.2 L 氯化氢气体中含有的分子数为0.5NA | |
| C. | NA个甲烷分子和1mol甲烷的质量相等 | |
| D. | 1 mol•L-1 CuCl2溶液中含有的氯离子数为2NA |
13.下列溶液中,溶质的物质的量浓度不是1mol/L的是( )
| A. | 10g NaOH固体溶解在水中配成250mL溶液 | |
| B. | 将80g SO3溶于水并配成1L的溶液 | |
| C. | 将100mL浓度为0.5mol/L的NaNO3溶液加热蒸发50克水 | |
| D. | 标况下,将22.4L氯化氢气体溶于水配成1L溶液 |
14.除去乙酸乙酯中的乙酸最好的方法是( )
| A. | 用水洗 | B. | 用盐酸洗 | ||
| C. | 用氢氧化钠溶液洗 | D. | 用饱和Na2CO3溶液 |
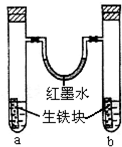 如图装置中,U型管内为红墨水,a,b试管内分别盛有是食盐水和醋酸溶液,各加入生铁快,放置右方时间,请回答下列问题:
如图装置中,U型管内为红墨水,a,b试管内分别盛有是食盐水和醋酸溶液,各加入生铁快,放置右方时间,请回答下列问题: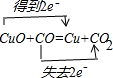 .
.