题目内容
下列反应中不可能设计成原电池的是( )
- A.NaOH+HCl===NaCl+H2O
- B.2Fe3++Fe===3Fe2+
- C.Zn+2HCl===ZnCl2+H2↑
- D.4Al+3O2+6H2O===4Al(OH)3↓
A
试题分析:只有氧化还原反应才能设计成原电池,据此可知选项BCD都可以设计成原电池,A是中和反应,不是氧化还原反应,不能设计成原电池,答案选A。
考点:考查原电池构成以及原电池组成的有关判断
点评:该题主要是考查学生对原电池原理的熟悉了解程度,意在检验学生灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池的构成条件,并能结合题意灵活运用即可。
试题分析:只有氧化还原反应才能设计成原电池,据此可知选项BCD都可以设计成原电池,A是中和反应,不是氧化还原反应,不能设计成原电池,答案选A。
考点:考查原电池构成以及原电池组成的有关判断
点评:该题主要是考查学生对原电池原理的熟悉了解程度,意在检验学生灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池的构成条件,并能结合题意灵活运用即可。

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
下列反应中不可能设计成原电池的是( )
| A.NaOH+HCl===NaCl+H2O | B.2Fe3++Fe===3Fe2+ |
| C.Zn+2HCl===ZnCl2+H2↑ | D.4Al+3O2+6H2O===4Al(OH)3↓ |
(16分)Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
| A.FeCl3 | B.FeCl2 | C.CuCl2 | D.FeS |
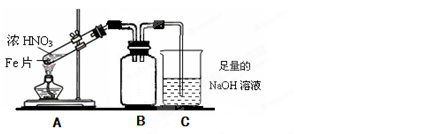
(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如上图所示的实验装置,请说出装置B的作用: 。开始加热前 (填“有”或“无”)明显现象。
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是 ;该反应的离子方程式为 。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由: (若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为 _________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):① ②