题目内容
在容积相同的两密闭容器A和B中,保持温度为423K,同时向A和B中分别加入a mol和b mol HI气体(a>b),待反应2HI(g)  H2(g)+I2(g)达到平衡,下列说法中肯定正确的是( )
H2(g)+I2(g)达到平衡,下列说法中肯定正确的是( )
 H2(g)+I2(g)达到平衡,下列说法中肯定正确的是( )
H2(g)+I2(g)达到平衡,下列说法中肯定正确的是( )分析:容器A中反应物浓度大于容器B,但效果只是A中反应速率快,所需时间短,由于A容器中物质浓度大,故A的压强较大,增大压强反应向气体体积减小方向进行.但因为这个反应前后物质计量数之和都是2,所以不存在气体体积减小方向,平衡不移动,即压强对转化率没有影响,当平衡时A、B中HI的转化率是相同的.由于A中投料多,所以HI转化为更多的碘,体积相同,所以A容器中碘蒸气浓度更高.
解答:解:A、容器中A中反应物的浓度大,反应速率大,达平衡需要的时间少,故A错误;
B、两容器中平衡时HI的转化率相同,故B正确;
C、平衡时A、B中HI的转化率相同,设转化率为x,平衡时A容器中:HI物质的量为a-ax,H2和I2均为
ax;平衡时B容器中:HI物质的量为b-bx,H2和I2为
bx,体积百分含量(也就是物质的量的百分含量)为
x,所以是相同的,故C错误;
D、A容器中各物质的浓度比B容器中各物质的浓度大,故D错误.
故选B.
B、两容器中平衡时HI的转化率相同,故B正确;
C、平衡时A、B中HI的转化率相同,设转化率为x,平衡时A容器中:HI物质的量为a-ax,H2和I2均为
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
D、A容器中各物质的浓度比B容器中各物质的浓度大,故D错误.
故选B.
点评:本题考查了反应前后气体体积不变的化学反应的等效平衡,在达到平衡时的各量的变化,化学平衡的计算.

练习册系列答案
相关题目
 (2)在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入amol和2amol的HI气体,待反应:2HI(g) H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”)
(2)在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入amol和2amol的HI气体,待反应:2HI(g) H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”) (2)在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入amol和2amol的HI气体,待反应:2HI(g)
H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”)
(2)在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入amol和2amol的HI气体,待反应:2HI(g)
H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”)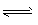 H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”) I2的浓度c(I2)A____c(I2)B,,I2蒸气在混合气体中的体积分数A容器______B容器
H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”) I2的浓度c(I2)A____c(I2)B,,I2蒸气在混合气体中的体积分数A容器______B容器