题目内容
9. 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为:Cu+H2O2+2HCl═2H2O+CuCl2.
(2)在一定体积的10mol•L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积大于(填“大于”、“等于”或“小于”)180mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),理由为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(3)根据图操作及现象推断酸X为B(填序号).
A.浓盐酸B.浓硫酸C.浓硝酸D.稀硝酸.
分析 (1)H2O2具有氧化性,O得到电子,Cu失去电子,结合电子及原子守恒分析;
(2)如Cu与浓硫酸完全反应,被还原的硫酸为0.9mol,则参加反应的硫酸为0.9mol×2=1.8mol,体积为$\frac{1.8mol}{10mol/L}$=0.18L=180mL,但随反应进行,浓硫酸浓度减小,变为稀硫酸时与Cu不反应;硝酸盐在酸性条件下具有强氧化性,可氧化Cu;
(3)常温下Fe遇浓硫酸、浓硝酸发生钝化,且图中溶解后加氯化钡生成白色沉淀,白色沉淀为硫酸钡.
解答 解:(1)H2O2具有氧化性,O得到电子,Cu失去电子,由电子及原子守恒可知反应为Cu+H2O2+2HCl═2H2O+CuCl2,
故答案为:Cu+H2O2+2HCl═2H2O+CuCl2;
(2)如Cu与浓硫酸完全反应,被还原的硫酸为0.9mol,则参加反应的硫酸为0.9mol×2=1.8mol,体积为$\frac{1.8mol}{10mol/L}$=0.18L=180mL,但随反应进行,浓硫酸浓度减小,变为稀硫酸时与Cu不反应,则则浓硫酸的实际体积大于180mL;硝酸盐在酸性条件下具有强氧化性,可氧化Cu,则使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),理由为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:大于;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)常温下Fe遇浓硫酸、浓硝酸发生钝化,且图中溶解后加氯化钡生成白色沉淀,白色沉淀为硫酸钡,则X为浓硫酸,故答案为:B.
点评 本题考查Cu及常见酸的性质,为高频考点,把握物质的性质、发生的反应为解答本题关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案| A. | 41 | B. | 72 | C. | 113 | D. | 185 |
| A. | 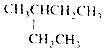 2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2 二溴乙烷 | ||
| C. | 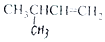 2-甲基丁烯 2-甲基丁烯 | D. |  苯甲醇 苯甲醇 |
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 吸热反应在需要在加热条件下才能发生 | |
| D. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 |

| A. | 还原性 | B. | 与水反应的剧烈程度 | ||
| C. | 熔点 | D. | 原子半径 |
 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义. 在一密闭容器中发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
 .
. .
.