题目内容
配制100mL.1.0mol?L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是( )A.容量瓶使用前经蒸馏水清洗后没有干燥
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.俯视确定凹液面与刻度线相切
D.用敞口容器称量NaOH且时间过长
【答案】分析:根据c=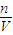 分析判断误差,如果n偏大或V偏小则配制溶液浓度偏高.
分析判断误差,如果n偏大或V偏小则配制溶液浓度偏高.
解答:解:A.配制最后需加水定容,故容量瓶使用前有少量蒸馏水,对所配溶液浓度无影响,故A错误;
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,溶质的物质的量偏小,配制溶液浓度偏低,故B错误;
C.俯视确定凹液面与刻度线相切,溶液的体积偏小,配制溶液浓度偏高,故C正确;
D.用敞口容器称量NaOH且时间过长,溶质的物质的量偏小,配制溶液浓度偏低,故D错误;
故选C.
点评:本题考查误差分析,正确理解c= 是解本题关键,难度不大.
是解本题关键,难度不大.
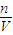 分析判断误差,如果n偏大或V偏小则配制溶液浓度偏高.
分析判断误差,如果n偏大或V偏小则配制溶液浓度偏高.解答:解:A.配制最后需加水定容,故容量瓶使用前有少量蒸馏水,对所配溶液浓度无影响,故A错误;
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,溶质的物质的量偏小,配制溶液浓度偏低,故B错误;
C.俯视确定凹液面与刻度线相切,溶液的体积偏小,配制溶液浓度偏高,故C正确;
D.用敞口容器称量NaOH且时间过长,溶质的物质的量偏小,配制溶液浓度偏低,故D错误;
故选C.
点评:本题考查误差分析,正确理解c=
 是解本题关键,难度不大.
是解本题关键,难度不大. 
练习册系列答案
相关题目
下列实验操作正确的是( )
| A、某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有SO42- | B、用托盘天平称取5.85gNaCl固体,配制100mL、1.0mol/L的NaCl溶液 | C、蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片 | D、用二硫化碳清洗残留在试管壁上少量的硫粉 |