题目内容
【题目】在反应2H2SO4 (浓)+Cu![]() CuSO4+2H2O+SO2 ↑中,
CuSO4+2H2O+SO2 ↑中,
(1)氧化剂是________;还原剂是________;氧化产物是________;还原产物是_______
(2)作为氧化剂的H2SO4和参加反应H2SO4物质的量之比为________;被还原的H2SO4和未被还原的H2SO4物质的量之比为________;氧化产物和还原产物物质的量之比为________;氧化剂和还原剂物质的量之比为________;
(3)在下面的化学方程式上用双线桥标电子转移的方向和数目2H2SO4 (浓)+Cu![]() CuSO4+2H2O+SO2 ↑_________
CuSO4+2H2O+SO2 ↑_________
(4)有1mol H2SO4参加反应,被氧化的Cu为______mol,转移的电子数目为________mol,生成的SO2为______L(标准状况下)。
【答案】H2SO4 Cu CuSO4 SO2 1:2 1:1 1:1 1:1 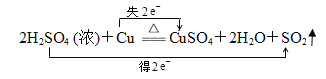 0.5 1 11.2
0.5 1 11.2
【解析】
在反应2H2SO4 (浓)+Cu![]() CuSO4+2H2O+SO2 ↑中,Cu元素的化合价升高,Cu为还原剂,CuSO4为氧化产物;S元素的化合价降低,H2SO4为氧化剂,SO2为还原产物,结合氧化还原反应基本概念与原理来解答。
CuSO4+2H2O+SO2 ↑中,Cu元素的化合价升高,Cu为还原剂,CuSO4为氧化产物;S元素的化合价降低,H2SO4为氧化剂,SO2为还原产物,结合氧化还原反应基本概念与原理来解答。
(2)假设参加反应的浓硫酸有2 mol,其中有1 mol+6价的S化合价降低,被还原,作氧化剂,生成了1 mol还原产物SO2;1 mol 0 价的单质Cu被氧化,作还原剂,生成了1 mol氧化产物CuSO4;
(3)反应中Cu的化合价升高2,S的化合价降低2,转移2个电子;
(4)由反应可知,生成1 mol CuSO4转移2 mol电子,该反应过程中转移了0.2mol电子,则生成0.1 mol CuSO4和0.1 mol SO2。
(1)在反应2H2SO4 (浓)+Cu![]() CuSO4+2H2O+SO2↑中,Cu元素的化合价升高,Cu为还原剂,CuSO4为氧化产物;S元素的化合价降低,H2SO4为氧化剂,SO2为还原产物,
CuSO4+2H2O+SO2↑中,Cu元素的化合价升高,Cu为还原剂,CuSO4为氧化产物;S元素的化合价降低,H2SO4为氧化剂,SO2为还原产物,
故答案为:H2SO4 ;Cu;CuSO4;SO2 ;
(2)假设参加反应的浓硫酸有2 mol,其中有1 mol +6价的S化合价降低,被还原,作氧化剂,生成了1 mol还原产物SO2;1 mol 0 价的单质Cu被氧化,作还原剂,生成了1 mol氧化产物CuSO4;因此作为氧化剂的H2SO4和参加反应H2SO4物质的量之比为1:2;被还原的H2SO4和未被还原的H2SO4物质的量之比为1:1;氧化产物和还原产物物质的量之比为1:1;氧化剂和还原剂物质的量之比为1:1;
故答案为:1:2;1:1;1:1;1:1;
(3)反应中Cu的化合价升高2,S的化合价降低2,转移2个电子,则用双线桥标出电子转移的方向和数目: ;
;
故答案为: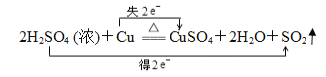 ;
;
(4)在反应2H2SO4 (浓)+Cu![]() CuSO4+2H2O+SO2 ↑中,由关系式2H2SO4
CuSO4+2H2O+SO2 ↑中,由关系式2H2SO4![]() Cu
Cu![]() 2e-
2e-![]() SO2可知,当有有1mol H2SO4参加反应,被氧化的Cu为0.5 mol;转移的电子数目为1 mol,生成的SO2为0.5 mol,因此在标准状况下,再根据V = n Vm得,生成的SO2体积为V = 0.5 mol ×22.4 L/mol = 11.2 L。
SO2可知,当有有1mol H2SO4参加反应,被氧化的Cu为0.5 mol;转移的电子数目为1 mol,生成的SO2为0.5 mol,因此在标准状况下,再根据V = n Vm得,生成的SO2体积为V = 0.5 mol ×22.4 L/mol = 11.2 L。
故答案为: 0.5;1;11.2。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】将气体A、B置于固定容积为4L的密闭容器中,发生如下反应:2A(g)+B(g)![]() C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
(1)用生成物C表示20s内的平均反应速率为_________________mol/(L·s)。
(2)反应前A的物质的量浓度是________________mol/L。
(3)反应达平衡时,B的转化率为________________ 。
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
编号 | 改变的条件 | D的生成速率 |
① | 降低体系温度 | ______ |
② | 恒容下补充A气体 | ______ |
③ | 恒容下充入Ne(不参与体系反应) | ______ |

