题目内容
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是( )
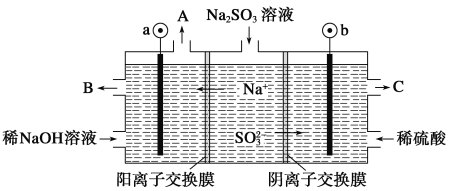
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO32--2e-+H2O===SO42-+2H+
D.电解过程中阴极区碱性明显增强
【答案】B
【解析】
试题分析:A、Na+移向阴极区,SO32-移向阳极区,所以a极为阴极,应接电源负极,故A正确;B、阴极区放电离子为氢离子生成氢气,阴极电极反应式为2H2O+2e-═H2↑+2OH-,A口出来的是氢气,b极应接电源正极,阳极电极反应式为SO32--2e-+H2O═SO42-+2H+,所以A口放出的物质是氢气,从C口流出的是浓度较大的硫酸,故B错误;C、b为阳极,SO32-在阳极失去电子变成SO42-,阳极电极反应式为SO32--2e-+H2O═SO42-+2H+,故C正确;D、在阴极区,由于H+放电,破坏水的电离平衡,c(H+)减小,c(OH-)增大,生成NaOH,碱性增强,故D正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目