题目内容
(13分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为__。
(2)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)? △H=+468.2 kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1。
则Fe(s)与O2 (g)反应生成Fe2 O3 (s)的热化学方程式为______________________。
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在_____滴定管中;
②判断达到滴定终点的现象是_____;
③用硫酸酸化的0.020 00 mol·L-1。KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表:
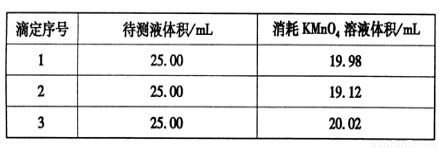
请分析数据并计算,该FeSO4溶液的物质的量浓度为_____。
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如下图:
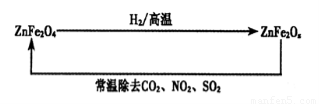
①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=_____;
②用ZnFe2Ox除去SO2的过程中,氧化剂是_____。
(1)Fe2O3+2Al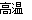 Al2O3+2Fe (2)4Fe(s)+3O2 (g)=2Fe2O3(s) △H=-1648.7kJ/mol
Al2O3+2Fe (2)4Fe(s)+3O2 (g)=2Fe2O3(s) △H=-1648.7kJ/mol
(3)①酸式? ②溶液恰好变浅紫红色,且半分钟内不褪色 ③0.080 00 mol·L-1
(4)①3.5?? ②SO2
【解析】
试题分析:(1)氧化铁与铝反应发生的是铝热反应,方程式为Fe2O3+2Al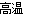 Al2O3+2Fe;
Al2O3+2Fe;
(2)已知:①2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)? △H=+468.2 kJ·mol-1、②C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1。则根据盖斯定律可知②×3-①即得到反应4Fe(s)+3O2 (g)=2Fe2O3(s),所以该反应的反应热△H=-393.5 kJ/mol×3-468.2 kJ/mol=-1648.7kJ/mol;
(3)①酸性KMnO4溶液具有强氧化性和酸性,应盛放在酸式滴定管中;
②由于酸性高锰酸钾溶液显紫红色,所以判断达到滴定终点的现象是溶液恰好变浅紫红色,且半分钟内不褪色;
③根据表中数据可知,第二次实验中消耗高锰酸钾溶液的体积与其余二次相差较大,舍去不用,因此消耗高锰酸钾溶液的体积平均值为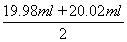 =20.00ml,所以根据方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知,FeSO4溶液的物质的量浓度为
=20.00ml,所以根据方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知,FeSO4溶液的物质的量浓度为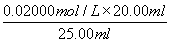 ×5=0.080 00 mol·L-1。
×5=0.080 00 mol·L-1。
(4)①已知ZnFe2O4与H2反应的物质的量之比为2:1,则根据原子守恒可知,反应中还生成1分子水,所以ZnFe2Ox中x=(4×2-1)÷2=3.5;
②在ZnFe2Ox中铁元素的化合价是+2.5价,而反应后变为+3价,化合价升高,失去电子,做还原剂,因此氧化剂是二氧化硫。
考点:考查铝热反应、盖斯定律、氧化还原反应滴定、氧化还原反应的有关判断与计算

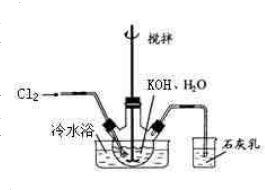 冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.
冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液. 5KCl+KClO3+3H2O,
5KCl+KClO3+3H2O,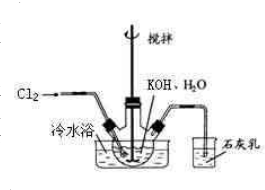 冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.
冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.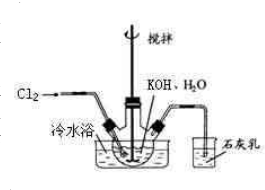
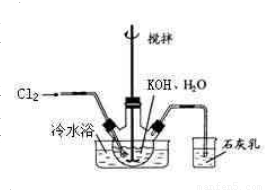 冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.
冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.