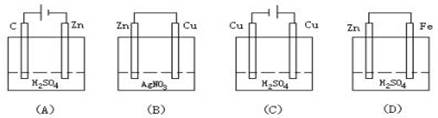
题目内容
(12分)新型高能钠硫电池以熔融的钠?硫为电极,以钠离子导电的陶瓷为固体电解质?该电池放电时为原电池,充电时为电解池?反应原理为:2Na+ xS = Na2Sx?
请回答下列问题:
(1)放电时S发生________反应,Na为______极?
(2)充电时Na所在电极与直流电源________极相连?
(3)充电时阳极反应为_________________;放电时负极反应为_______________?
(4)用此电池电解饱和NaCl溶液,当阳极产生11.2 L(标准状况下)气体时,消耗金属钠_____g?
请回答下列问题:
(1)放电时S发生________反应,Na为______极?
(2)充电时Na所在电极与直流电源________极相连?
(3)充电时阳极反应为_________________;放电时负极反应为_______________?
(4)用此电池电解饱和NaCl溶液,当阳极产生11.2 L(标准状况下)气体时,消耗金属钠_____g?
(1)还原;负 (2)负 (3)Sx2--2 e-=xS ; Na - e-= Na+ (4)23
原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。根据总反应式可判断,钠在负极失去电子,电极反应式为Na - e-= Na+。硫在正极得到电子,即钠是负极,硫是正极。当充电时负极和电源当负极相连,作阴极。正极和电源的正极相连,作阳极,因此阳极反应式为Sx2--2e-=xS。电解饱和氯化钠溶液时阳极氯离子放电,反应式为2Cl--2e-=Cl2↑,即生成0.5mol氯气时,转移电子是1mol。因此根据得失电子守恒可知,消耗钠是1mol,质量是23g。

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目