题目内容
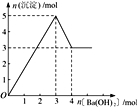
【题目】室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10﹣9 mol2/L2 , 下列说法不正确的是( ) 
A.x数值为2×10﹣5
B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d点变到a点
D.b点与d点对应的溶度积相等
【答案】C
【解析】解:A.在d点c(CO32﹣)=1.4×10﹣4 molL﹣1 , 因室温时,CaCO3的溶度积Ksp=2.8×10﹣9 , 所以c(Ca2+)=2×10﹣5 molL﹣1 , 故x的数值为2×10﹣5 , 故A正确;
B.在c点c(Ca2+)>×10﹣5 molL﹣1 , 即相当于增大c(Ca2+),平衡左移,有CaCO3生成,故B正确;
C.d点为饱和溶液,加入蒸馏水后如仍为饱和溶液,则c(Ca2+)、c(CO32﹣)都不变,如为不饱和溶液,则二者浓度都减小,故不可能使溶液由d点变成a点,故C错误;
D.b点与d点在相同的温度下,溶度积相等,故D正确.
故选:C.
CaCO3在水中的沉淀溶解平衡为CaCO3(s)Ca2+(aq)+CO32﹣(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题.

 阅读快车系列答案
阅读快车系列答案【题目】下列实验中,对应的现象以及原理都不正确的是
选项 | 实验 | 现象 | 原理 |
A. | 向盛有2mLNa2SO4溶液的试管中加入2mLBaCl2溶液。 | 白色沉淀 | Ba2++SO |
B. | 向盛有2mL稀NaOH溶液的试管中加入2mL稀HCl溶液。 | 无现象 | OH-+H+===H2O |
C. | 向盛有2mLCuSO4溶液的试管中加入2mL稀NaOH溶液。 | 蓝色沉淀 | Cu2++2OH-= Cu(OH)2↓ |
D. | 向盛有2mLNa2CO3溶液的试管中加入2mLH2SO4溶液(过量)。 | 无现象 | CO32- + H+ = H2CO3 |
A. A B. B C. C D. D