题目内容
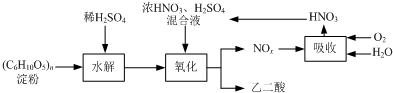
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:
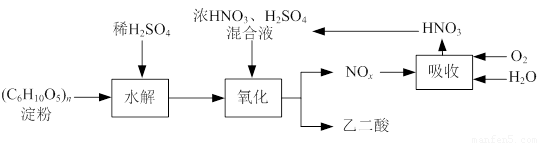
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
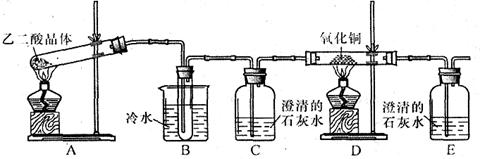
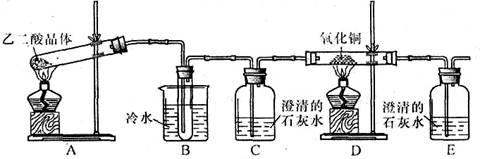
⑴检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
⑵氧化时控制反应液温度为55~60℃的原因是 。
⑶若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
⑷生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
⑴取氧化后所得溶液,加入过量NaOH溶液,再向其中加入新制Cu(OH)2,加热。若有砖红色沉淀产生,说明含有葡萄糖。 (2分)
⑵若温度过低反应过慢,若温度过高硝酸会分解(或挥发) (2分)
⑶28.8 kg (2分) ⑷3.6kg(6分)
【解析】
试题分析:(1)葡萄糖中含有醛基,据此可以鉴别和检验,即取氧化后所得溶液,加入过量NaOH溶液,再向其中加入新制Cu(OH)2,加热。若有砖红色沉淀产生,说明含有葡萄糖。
(2)由于温度过低反应过慢,而温度过高硝酸会分解(或挥发),所以氧化时应该控制反应液温度为55~60℃。
(3)根据反应的方程式可知,(C6H10O5)n~n C6H12O6~3nH2C2O4
所以根据题意可知30 kg淀粉可生产乙二酸的质量为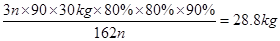 。
。
(4)设每产生9 kg H2C2O4反应中产生NO2的物质的量为x,产生NO的物质的量为y
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
18 3 18
x x/6 x
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
6 3 6
y y/2 y
x=2y
(x/6+y/2)×90 g·mol-1=9×103 g
x="240" mol y="120" mol
需补充的硝酸m(HNO3)="360" mol×(1-90%)×63 g·mol-1÷63%
="3600" g="3.6" kg
考点:考查葡萄糖的检验、反应条件的控制、产物的计算
点评:该题是中等难度的试题,试题基础性强,难易适中。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练。旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力以及规范答题能力。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案