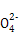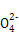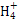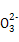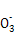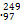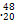题目内容
(1)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为 。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1 mol·L-1硫酸铝溶液;②0.1 mol·L-1氯化钡溶液;③蒸馏水;④0.1 mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是 (用序号填写)。
(3)常温下,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合,当溶液中c(N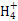 )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= 。
(1)107∶1 (2)②>③>④>① (3)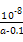
【解析】(1)0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,恰好生成NaA,水解促进水的电离,已知pH=8,故由水电离出的c(OH-)=10-6;NaOH抑制水的电离,0.1 mol·L-1 NaOH溶液的c(OH-)=0.1 mol·L-1,故由水电离出的c(OH-)=c(H+)=10-13,两者之比为107∶1。(2)一定温度下,c(S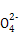 )·c(Ba2+)为定值,c(S
)·c(Ba2+)为定值,c(S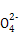 )越小,c(Ba2+)越大,故c(Ba2+)由大到小的顺序是②>③>④>①。(3)根据溶液电中性,c(H+)+c(N
)越小,c(Ba2+)越大,故c(Ba2+)由大到小的顺序是②>③>④>①。(3)根据溶液电中性,c(H+)+c(N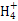 )=c(OH-)+c(Cl-),已知c(N
)=c(OH-)+c(Cl-),已知c(N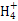 )=c(Cl-)=
)=c(Cl-)=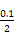 mol·L-1,故c(OH-)=c(H+)=10-7 mol·L-1。根据物料守恒,c(NH3·H2O)+c(N
mol·L-1,故c(OH-)=c(H+)=10-7 mol·L-1。根据物料守恒,c(NH3·H2O)+c(N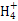 )=
)= mol·L-1,故c(NH3·H2O)=
mol·L-1,故c(NH3·H2O)=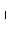
 -
-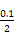
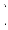 mol·L-1=
mol·L-1=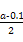 mol·L-1。代入Kb=
mol·L-1。代入Kb= =
=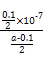 =
=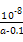 。
。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | S |
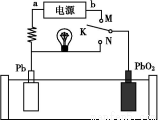
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:

(1) M为直流电源的 极,b电极上发生的电极反应为 。
(2)计算e电极上生成的气体在标准状况下的体积为 。
(3)写出乙烧杯中的总反应的离子方程式: 。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量) 。