题目内容
【题目】一定量的浓硝酸与44.8g的铜反应,铜片完全溶解后收集到标况下混合气体NO和NO2的体积为22.4L,不考虑NO2与N2O4的相互转化,试计算下列相关问题:(要求写出计算过程)
(1)消耗的硝酸物质的量.
(2)混合气体中NO2、NO的体积.
(3)相同条件下,上述反应生成的NO2、NO分别被水恰好吸收时所需的O2体积比.
【答案】
(1)解:发生反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
n(Cu)= ![]() =0.7mol,n(气体)=
=0.7mol,n(气体)= ![]() =1mol,参加反应的硝酸的物质的量为2n(Cu)+n(气体)=2×0.7mol+1 mol=2.4mol,
=1mol,参加反应的硝酸的物质的量为2n(Cu)+n(气体)=2×0.7mol+1 mol=2.4mol,
答:参加反应的硝酸的物质的量是2.4mol
(2)解:设NO2和NO分别为xmol、ymol,
则x+y=1→①,根据化合价升降守恒知同元素化合价的升高=氮元素的化合价降低,3x+y=0.7×2→②,
解得x=1=0.2mol,y=0.8mol,
所以V(NO)=0.2mol×22.4L/mol=4.48L;=V(NO2)=0.8mol×22.4L/mol=17.92L,
答:混合气体中V(NO)=4.48L;=V(NO2)=17.92L
(3)解:根据整个过程分析,要计算上述反应生成的NO2、NO分别被水恰好吸收时所需的O2体积比,则氧气化合价的降低等于氮元素化合价升高,故NO需氧气的体积= ![]() =3.36L,NO2需氧气的体积=
=3.36L,NO2需氧气的体积= ![]() =4.48L.
=4.48L.
答:上述反应生成的NO2、NO分别被水恰好吸收时所需的O2体积比=4.48:3.36=28:21.
【解析】发生反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,n(Cu)= ![]() =0.7mol,结合原子守恒、化合价升降守恒及反应计算.
=0.7mol,结合原子守恒、化合价升降守恒及反应计算.

 夺冠金卷全能练考系列答案
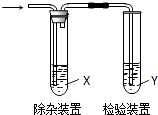
夺冠金卷全能练考系列答案【题目】用如图所示装置检验乙烯时不需要除杂的是( )
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
A.A
B.B
C.C
D.D