题目内容
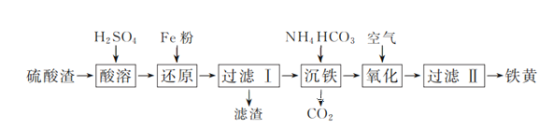
【题目】水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:__________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。(已知反应:I2+2S2O32-=2I-+S4O62-)计算该水样中的溶解氧(以mg·L1表示),写出计算过程__________。
【答案】O2+2Mn2++4OH-=2MnO(OH)2↓ 在100.00ml水样中发生反应:I2+2S2O32-=2I-+S4O62-,消耗0.01000mol/LNa2S2O3标准液13.50mL,则转化n(I2)=![]() 13.5010-30.01000mol=6.75010-5mol,MnO(OH)2与I完全反应生成Mn2+和I2,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.75010-5mol,再根据电子得失守恒:n(O2)=
13.5010-30.01000mol=6.75010-5mol,MnO(OH)2与I完全反应生成Mn2+和I2,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.75010-5mol,再根据电子得失守恒:n(O2)=![]() n[MnO(OH)2]=
n[MnO(OH)2]=![]() 6.75010-5mol=3.37510-5mol,该水样中的溶解氧=
6.75010-5mol=3.37510-5mol,该水样中的溶解氧=![]() =10.80 mg·L1
=10.80 mg·L1
【解析】
①氧气将Mn2+氧化为MnO(OH)2,由生成物可知该反应是在碱性条件下反应,结合电子、电荷及原子守恒书写离子方程式;
②根据方程式计算转化I2的量,据此计算水样中的溶解氧量。
①氧气将Mn2+氧化为MnO(OH)2的反应中,氧气是氧化剂,1molO2得到4mol电子,锰元素的化合价由+2价升高到+4价,失去2个电子,由电子、电荷、以及原子守恒可知该反应的离子方程式为:O2+2Mn2++4OH-=2MnO(OH)2↓;
②在100.00ml水样中发生反应:I2+2S2O32-=2I-+S4O62-,消耗0.01000mol/LNa2S2O3标准液13.50mL,则转化n(I2)=![]() 13.5010-30.01000mol=6.75010-5mol,MnO(OH)2与I完全反应生成Mn2+和I2,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.75010-5mol,再根据电子得失守恒:n(O2)=
13.5010-30.01000mol=6.75010-5mol,MnO(OH)2与I完全反应生成Mn2+和I2,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.75010-5mol,再根据电子得失守恒:n(O2)=![]() n[MnO(OH)2]=
n[MnO(OH)2]=![]() 6.75010-5mol=3.37510-5mol,该水样中的溶解氧=
6.75010-5mol=3.37510-5mol,该水样中的溶解氧=![]() =10.80 mg·L1。
=10.80 mg·L1。