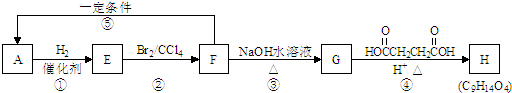
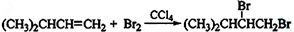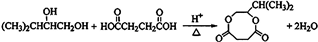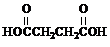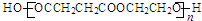题目内容
燃烧等物质的量的有机物A和乙醇,用去等量的氧气,此时乙醇反应生成的水的量是A生成水的量的1.5倍,但A生成的二氧化碳的量是乙醇生成二氧化碳的量的1.5倍.则有机物A是( )
| A、C2H6O | B、C2H4O2 | C、C3H4O2 | D、C3H4 |
分析:由乙醇C2H6O分子中C、H的个数,可确定A的分子式为C3H4Ox,再由消耗O2相等,即2+
-
=3+
-
,可确定A中氧原子为2,据此来解答.
| 6 |
| 4 |
| 1 |
| 2 |
| 4 |
| 4 |
| x |
| 2 |
解答:解:由乙醇C2H6O分子中C、H的个数,可确定A的分子式为C3H4Ox,再由消耗O2相等,即2+
-
=3+
-
,可确定A中氧原子为2,根据选项知道有机物A的分子式为C3H4O2,
故选:C.
| 6 |
| 4 |
| 1 |
| 2 |
| 4 |
| 4 |
| x |
| 2 |
故选:C.
点评:本题目主要考查了有机物燃烧的规律,难度中等,根据所学知识即可完成.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目