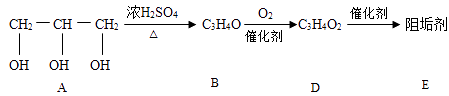
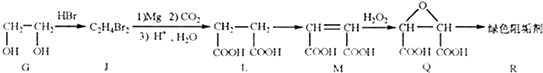题目内容
【题目】1﹣溴丙烷和2﹣溴丙烷分别与NaOH的乙醇溶液共热,关于两反应的说法正确的是( )
A.产物相同,反应类型相同
B.产物不同,反应类型不同
C.碳氢键断裂的位置相同
D.碳溴键断裂的位置相同
【答案】A
【解析】解:A.1﹣溴丙烷发生消去反应的方程式为:CH3CH2CH2Br+NaOH ![]() CH3CH=CH2↑+NaBr+H2O 2﹣溴丙烷发生消去反应的方程式为:
CH3CH=CH2↑+NaBr+H2O 2﹣溴丙烷发生消去反应的方程式为:
CH3CHBrCH3+NaOH ![]() CH3CH=CH2↑+NaBr+H2O,故A正确;
CH3CH=CH2↑+NaBr+H2O,故A正确;
B.1﹣溴丙烷和2﹣溴丙烷分别与NaOH的乙醇溶液共热,都发生消去反应,生成1﹣丙烯.故B错误;
C.1﹣溴丙烷在氢氧化钠的醇溶液中发生消去反应,反应断1号C的C﹣Br键和2号C的C﹣H键,2﹣溴丙烷在氢氧化钠的醇溶
液中发生消去反应,反应断1号C的C﹣H键和2号C的C﹣Br键.故C错误;
D.1﹣溴丙烷在氢氧化钠的醇溶液中发生消去反应,反应断1号C的C﹣Br键,2﹣溴丙烷在氢氧化钠的醇溶液中发生消去反应,反应断2号C的C﹣Br键.故D错误;
故选A.
卤代烃在氢氧化钠的水溶液中发生取代反应;卤代烃在氢氧化钠的醇溶液中发生消去反应,是与卤素原子相邻的碳上的一个氢同时脱去,形成不饱和键.

【题目】Na2SO3的氧化反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)△H=m kJmol﹣1 . 其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段.
(1)已知O2(g)O2(aq)△H=nkJmol﹣1 , Na2SO3溶液与O2(g)反应的热化学方程式为
(2)291.5K时,1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mgL﹣1 , 每5s记录溶解氧浓度,实验结果如图.当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mgL﹣1 , 则0﹣20s内Na2SO3的平均反应速率为molL﹣1s﹣1
(3)为确定贫氧区速率方程v=kca(SO32﹣)cb(O2)中a,b的值(取整数),分析实验数据.
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0mgL﹣1时,c(Na2SO3)与速率数值关系如表,则a=
②当溶解氧浓度小于4.0mgL﹣1时,图中曲线皆为直线,则b= ,
(4)两个阶段不同温度的速率常数(k)之比如表.
反应阶段 | 速率方程 |
|
富氧区 | v=kc(SO32﹣)c(O2) | 1.47 |
贫氧区 | v=kca(SO32﹣)cb(O2) | 2.59 |
已知ln ![]() =﹣
=﹣ ![]() (
( ![]() ),R为常数,Ea(富氧区)Ea(贫氧区)(填“>”或“<”).
),R为常数,Ea(富氧区)Ea(贫氧区)(填“>”或“<”).
(5)结合图表分析,Na2SO3初始量不同时,划分富氧区与贫氧区的溶解氧浓度是否相同,为什么?.
(6)一定温度下,化学反应速率仅与决速步的反应物浓度有关.Na2SO3氧化反应历程涉及的
①SO32﹣+O2→SO5﹣
②SO5﹣+SO32﹣→SO52﹣+SO3﹣
③SO32﹣+SO32﹣→SO3﹣+SO32﹣
④SO32﹣+O2→SO5﹣
⑤SO52﹣+SO32﹣→2SO42﹣
富氧区与和贫氧区的决速步分别是、(填序号)