题目内容
在硫酸铝、硫酸钾和明矾的混合溶液中,若c(SO42-)=0.2mol?L-1,当加入等体积等SO42-浓度的KOH溶液时,生成沉淀恰好溶解,则原混合物中c(K+)为( )
| A、0.2mol?L-1 | B、0.25mol?L-1 | C、0.1mol?L-1 | D、0.225mol?L-1 |
分析:硫酸铝、硫酸钾和明矾的混合溶液实际为硫酸铝、硫酸钾的混合溶液.加入等体积等SO42-浓度的KOH溶液时,生成的沉淀恰好完全溶解,发生总反应为:Al3++4OH-=AlO2-+2H2O,根据方程式可知,原溶液中c(Al3+)=
c(OH-),根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42),据此计算原溶液中K+离子的浓度.
| 1 |
| 4 |
解答:解:硫酸铝、硫酸钾和明矾的混合溶液实际为硫酸铝、硫酸钾的混合溶液.加入等体积等SO42-浓度 KOH溶液时,生成的沉淀恰好完全溶解,发生总反应Al3++4OH-=AlO2-+2H2O,根据方程式可知,n(Al3+)=
n(OH-),所以原溶液中c(Al3+)=
c(OH-)=
×0.2mol/L=0.05mol/L,根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42-),所以c(K+)=2c(SO42-)-3c(Al3+)=2×0.2mol/L-3×0.05mol/L=0.25mol/L,
故选:B.
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
故选:B.
点评:本题考查离子方程式的计算,难度中等,清楚反应过程判断原溶液中铝离子的浓度与氢氧化钠溶液的浓度关系是关键,注意电荷守恒应用.

练习册系列答案
相关题目
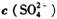 =0.4 mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
=0.4 mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为