题目内容
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm3,溶质的质量分数为ω,溶质的物质的量浓度为C mol / L 。下列叙述中正确的是
①ω=![]() ②C=
②C=![]()
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl―)>c(NH4+)>c(H+)>c(OH―)
A. ②④ B. ②③ C. ①③ D. ①④
【答案】A
【解析】①氨水中溶质可以看作的是NH3,溶质的质量为17a/22.4g,溶液的质量为Vρg,质量分数为17a/(22.4Vρ)×100%,故①错误;②根据物质的量浓度的定义,C=![]() ,故②正确;③加水稀释,溶质的质量不变,溶质的质量为17a/22.4g,溶液的质量为(Vρ+V)g,质量分数为17a/[22.4(Vρ+V)]×100%,故③错误;④加入1.5V等浓度的盐酸后,反应后的溶质为NH4Cl和HCl,NH4Cl的物质的量大于HCl的物质的量,NH4+发生水解,且水解程度微弱,因此离子浓度大小顺序是c(Cl―) > c(NH4+) > c(H+) > c(OH―),故④正确;综上所述,选项A正确。
,故②正确;③加水稀释,溶质的质量不变,溶质的质量为17a/22.4g,溶液的质量为(Vρ+V)g,质量分数为17a/[22.4(Vρ+V)]×100%,故③错误;④加入1.5V等浓度的盐酸后,反应后的溶质为NH4Cl和HCl,NH4Cl的物质的量大于HCl的物质的量,NH4+发生水解,且水解程度微弱,因此离子浓度大小顺序是c(Cl―) > c(NH4+) > c(H+) > c(OH―),故④正确;综上所述,选项A正确。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
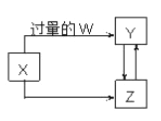
选项 | W | X |
A | 盐 酸 | Na2CO3溶液 |
B | Cl2 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | NaOH溶液 | AlCl3溶液 |
A. A B. B C. C D. D