题目内容
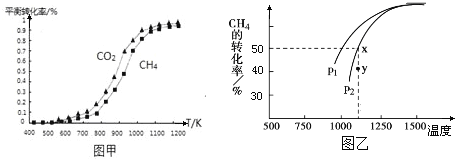
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是
A. 反应在0~10 s内,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 反应在0~10 s内,X的物质的量浓度减少了0.79 mol·L-1
C. 反应进行到10 s时,Y的转化率为79.0%
D. 反应的化学方程式为X(g)+Y(g)≒Z(g)
【答案】C
【解析】试题分析:根据图示,X、Y为反应物,Z为生成物,10 s时达到平衡。在0~10 s内,Z增加1.58 mol,用Z表示的反应速率为![]() 0.079 mol·L-1·s-1,故A错误;在0~10 s内,X减少0.79 mol,X的物质的量浓度减少了0.395 mol·L-1故B错误;反应进行到10 s时,Y减少0.79 mol,Y的转化率为
0.079 mol·L-1·s-1,故A错误;在0~10 s内,X减少0.79 mol,X的物质的量浓度减少了0.395 mol·L-1故B错误;反应进行到10 s时,Y减少0.79 mol,Y的转化率为![]() =79.0%,故C正确;根据Δn(X):Δn(Y):Δn(Z)="0.79" mol:0.79 mol:1.58 mol=1:1:2,得T°C时,该反应的化学方程式为:X(g)+Y(g)
=79.0%,故C正确;根据Δn(X):Δn(Y):Δn(Z)="0.79" mol:0.79 mol:1.58 mol=1:1:2,得T°C时,该反应的化学方程式为:X(g)+Y(g)![]() 2Z(g),故D错误。
2Z(g),故D错误。

【题目】下列物质的分类组合全部正确的是( )
编组 | 强电解质 | 弱电解质 | 非电解质 |
A | NaCl | H2O | Cl2 |
B | H2SO4 | CaCO3 | CCl4 |
C | AgCl | HClO | Cu |
D | Ba(OH)2 | H2S | C2H5OH |
A. A B. B C. C D. D
【题目】为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A. ①②③ B. ①②③④ C. ②③④ D. ①③④