题目内容
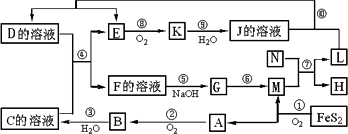
下图是多种无机物在一定条件下的转化关系(部分产物及反应条件未列出.)K是形成光化学烟雾及形成酸雨的一种主要气体,N为第三周期元素组成的单质熔点最高的金属,X是一种矿石的主要成份,常用来生产一种常见的化工产品.

回答:
(1)在周期表,组成单质L的元素位于第______ 周期第______ 族.
(2)K的名称为______,G的化学式______;
(3)已知FeS2的燃烧热为853KJ/mol,写出反应①的热化学方程式:______
(4)写出反应⑤的离子方程式:______写出⑩的离子方程式:______
(5)反应⑦中,若转移9mol电子,生成的L______ g.
解:由反应4FeS2+11O2  2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,M为Fe2O3,B为SO3,C为H2SO4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al2O3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体知K为NO2,J为HNO3,E为NO;又由L+HNO3 →D+NO↑分析知L为Fe,H为Al2O3;J应为Fe(NO3)3或Fe(NO3)2;联系反应④:D+H2SO4 →F+NO↑知,D为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;G应为Fe(OH)3,则
2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,M为Fe2O3,B为SO3,C为H2SO4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al2O3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体知K为NO2,J为HNO3,E为NO;又由L+HNO3 →D+NO↑分析知L为Fe,H为Al2O3;J应为Fe(NO3)3或Fe(NO3)2;联系反应④:D+H2SO4 →F+NO↑知,D为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;G应为Fe(OH)3,则
(1)L为Fe,位于周期表第四周期第Ⅷ族,故答案为:四;Ⅷ;
(2)K为NO2,名称为二氧化氮,G为Fe(OH)3,故答案为:二氧化氮;Fe(OH)3;
(3)根据燃烧热的概念可写出反应①的热化学方程式为FeS2(s)+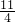 O2(g)
O2(g)
 Fe2O3(s)+2SO2(g);
Fe2O3(s)+2SO2(g);
△H=-853kJ/mol,
故答案为:FeS2(s)+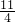 O2(g)
O2(g)
 Fe2O3(s)+2SO2(g);△H=-853kJ/mol;
Fe2O3(s)+2SO2(g);△H=-853kJ/mol;
(4)反应⑤为Fe3+与NaOH的反应,离子方程式为Fe3++3OH-═Fe(OH)3↓,
反应⑩为Fe在酸性条件下与NO3-的反应,反应的离子方程式为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,
故答案为:Fe3++3OH-═Fe(OH)3↓;3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O;
(5)2Al+Fe2O3 Al2O3+2Fe 转移电子
Al2O3+2Fe 转移电子
112g 6mol
m(Fe) 9mol
m(Fe)=168g,
故答案为:168.
分析:由反应4FeS2+11O2 2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,M为Fe2O3,B为SO3,C为H2SO4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al2O3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体可知K为NO2,J为HNO3,E为NO;又由L+HNO3 →D+NO↑分析知L为Fe,H为Al2O3;J应为Fe(NO3)3或Fe(NO3)2;联系反应④:D+H2SO4 →F+NO↑知,D为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;G应为Fe(OH)3,至此全部物质已确定,题目所涉及的问题可顺利解决.
2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,M为Fe2O3,B为SO3,C为H2SO4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al2O3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体可知K为NO2,J为HNO3,E为NO;又由L+HNO3 →D+NO↑分析知L为Fe,H为Al2O3;J应为Fe(NO3)3或Fe(NO3)2;联系反应④:D+H2SO4 →F+NO↑知,D为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;G应为Fe(OH)3,至此全部物质已确定,题目所涉及的问题可顺利解决.
点评:本题涉及铁及其化合物,Al、HNO3、H2SO4、NOx等内容,综合考查考生熟练运用元素化合物知识解决问题的能力,题目难度中等.
 2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,M为Fe2O3,B为SO3,C为H2SO4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al2O3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体知K为NO2,J为HNO3,E为NO;又由L+HNO3 →D+NO↑分析知L为Fe,H为Al2O3;J应为Fe(NO3)3或Fe(NO3)2;联系反应④:D+H2SO4 →F+NO↑知,D为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;G应为Fe(OH)3,则
2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,M为Fe2O3,B为SO3,C为H2SO4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al2O3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体知K为NO2,J为HNO3,E为NO;又由L+HNO3 →D+NO↑分析知L为Fe,H为Al2O3;J应为Fe(NO3)3或Fe(NO3)2;联系反应④:D+H2SO4 →F+NO↑知,D为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;G应为Fe(OH)3,则(1)L为Fe,位于周期表第四周期第Ⅷ族,故答案为:四;Ⅷ;
(2)K为NO2,名称为二氧化氮,G为Fe(OH)3,故答案为:二氧化氮;Fe(OH)3;
(3)根据燃烧热的概念可写出反应①的热化学方程式为FeS2(s)+
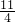 O2(g)
O2(g)
 Fe2O3(s)+2SO2(g);
Fe2O3(s)+2SO2(g);△H=-853kJ/mol,
故答案为:FeS2(s)+
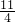 O2(g)
O2(g)
 Fe2O3(s)+2SO2(g);△H=-853kJ/mol;
Fe2O3(s)+2SO2(g);△H=-853kJ/mol;(4)反应⑤为Fe3+与NaOH的反应,离子方程式为Fe3++3OH-═Fe(OH)3↓,
反应⑩为Fe在酸性条件下与NO3-的反应,反应的离子方程式为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,
故答案为:Fe3++3OH-═Fe(OH)3↓;3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O;
(5)2Al+Fe2O3
 Al2O3+2Fe 转移电子
Al2O3+2Fe 转移电子112g 6mol
m(Fe) 9mol
m(Fe)=168g,
故答案为:168.
分析:由反应4FeS2+11O2
 2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,M为Fe2O3,B为SO3,C为H2SO4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al2O3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体可知K为NO2,J为HNO3,E为NO;又由L+HNO3 →D+NO↑分析知L为Fe,H为Al2O3;J应为Fe(NO3)3或Fe(NO3)2;联系反应④:D+H2SO4 →F+NO↑知,D为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;G应为Fe(OH)3,至此全部物质已确定,题目所涉及的问题可顺利解决.
2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,M为Fe2O3,B为SO3,C为H2SO4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al2O3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体可知K为NO2,J为HNO3,E为NO;又由L+HNO3 →D+NO↑分析知L为Fe,H为Al2O3;J应为Fe(NO3)3或Fe(NO3)2;联系反应④:D+H2SO4 →F+NO↑知,D为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;G应为Fe(OH)3,至此全部物质已确定,题目所涉及的问题可顺利解决.点评:本题涉及铁及其化合物,Al、HNO3、H2SO4、NOx等内容,综合考查考生熟练运用元素化合物知识解决问题的能力,题目难度中等.

练习册系列答案
相关题目
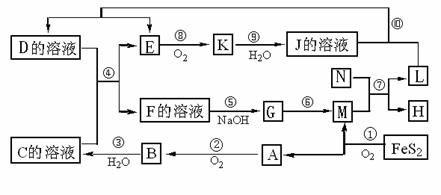
下图是多种无机物在一定条件下的转化关系(部分产物及反应条件未列出。)K是形成光化学烟雾及形成酸雨的一种主要气体,N为第三周期元素组成的单质熔点最高的金属,FeS2是一种矿石的主要成份,常用来生产一种重要的强酸。
|
回答:
(1)在周期表,组成单质L的元素位于第 周期第 族。
(2)K的名称为 ,G的化学式 ;
(3)写出反应⑤的离子方程式:
写出⑩的离子方程式:
(4)反应⑦中,若转移9 mol电子,生成的L g。