题目内容
【题目】下图是元素周期表的一部分,表中所列字母分别代表一种元素。
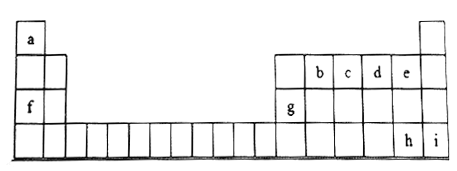
根据表格所给信息,回答下列问题:
(1)c元素原子的最高价氧化物对应的水化物的化学式___________(填化学式)
(2)b、c、d、e的原子半径依次_______(填“增大”或“减小”)
(3)e、h元素原子形成的氢化物中,热稳定性大的是__________(填氢化物的化学式)
(4)f、g元素的最高价氧化物对应水化物之间发生反应的化学方程式__________________
【答案】 HNO3 减少 HF NaOH+Al(OH)3 =Na [Al(OH)4]
【解析】由元素在周期表中位置可知,a为H、b为C、c为N、d为O、e为F、f为Na、g为Al、h为Br,i为Kr。
(1)c的最高价氧化物对应的水化物为硝酸,化学式为HNO3,故答案为:HNO3;
(2)同周期从左向右原子半径减小,则b、c、d、e的原子半径依次减小,故答案为:减小;
(3)非金属性越强,对应氢化物越稳定,则HF更稳定,故答案为:HF;
(4)f、g的最高价氧化物对应水化物分别为氢氧化钠和氢氧化铝,二者反应的化学方程式为NaOH+Al(OH)3 =Na [Al(OH)4]或Al(OH)3 + 2NaOH=NaAlO2 + 2H2O,故答案为:NaOH+Al(OH)3 =Na [Al(OH)4]或Al(OH)3 + 2NaOH=NaAlO2 + 2H2O。

练习册系列答案
相关题目