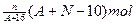题目内容
A、B、C三种主族元素在周期表中的位置相邻,它们的原子序数 依次增大。A、B原子的电子层相同,B、C原子的最外层电子数相同。已知三种元素
依次增大。A、B原子的电子层相同,B、C原子的最外层电子数相同。已知三种元素 原子的最外层电子数之和为17,质子数之和为31。
原子的最外层电子数之和为17,质子数之和为31。

写出:(1)A单质的电子式为 ;(2)B氢化物的结构式为 ;
(3)用电子式表示C氢化物的形成过程 。
 依次增大。A、B原子的电子层相同,B、C原子的最外层电子数相同。已知三种元素
依次增大。A、B原子的电子层相同,B、C原子的最外层电子数相同。已知三种元素 原子的最外层电子数之和为17,质子数之和为31。
原子的最外层电子数之和为17,质子数之和为31。
写出:(1)A单质的电子式为 ;(2)B氢化物的结构式为 ;
(3)用电子式表示C氢化物的形成过程 。
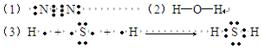
略

练习册系列答案
相关题目
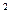 2s
2s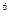 3s
3s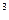 4s
4s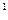 ,则该元素基态原子的价电子的轨道表示式为 ;元素符号为 ;其最高价氧化物对应的水化物的化学
,则该元素基态原子的价电子的轨道表示式为 ;元素符号为 ;其最高价氧化物对应的水化物的化学 式是 。水溶液为 性(酸性或碱性)
式是 。水溶液为 性(酸性或碱性) 。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答: —H,键能关系为
—H,键能关系为 、“>”或“=”)。
、“>”或“=”)。 晶体。
晶体。