题目内容
18.下列各离子组在指定的溶液中一定能大量共存的是( )①常温在$\frac{C({H}^{+})}{C(O{H}^{-})}$=10-10溶液中:K+、Na+、CH3COO-、SO42-
②常温pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③水电离出的H+浓度c(H+)=10-12mol•L?1的溶液中:Cl-、NO3-、Na+、S2O32-
④使甲基橙变红色的溶液中:Fe3+、NO3-、Na+、SO42-.
| A. | ①②③ | B. | ①②④ | C. | ②③ | D. | ③④ |
分析 ①常温$\frac{C({H}^{+})}{C(O{H}^{-})}$=10-10溶液呈碱性;
②pH=11的溶液呈碱性;
③水电离出的H+浓度c(H+)=10-12mol•L?1的溶液可能呈酸性或碱性;
④使甲基橙变红色的溶液呈酸性.
解答 解:①常温$\frac{C({H}^{+})}{C(O{H}^{-})}$=10-10溶液呈碱性,碱性条件下离子之间不反应,可大量共存,故正确;
②pH=11的溶液呈碱性,碱性条件下离子之间不反应,可大量共存,故正确;
③水电离出的H+浓度c(H+)=10-12mol•L?1的溶液可能呈酸性或碱性,酸性条件下S2O32-不能大量稳定存在,故错误;
④使甲基橙变红色的溶液呈酸性,酸性条件下离子之间不反应,可大量共存,故正确.
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
8.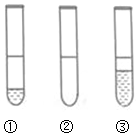 在3支试管中分别装有:①lmL苯和3mL水:②lmLCCl4和3mL水;③lmL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )
在3支试管中分别装有:①lmL苯和3mL水:②lmLCCl4和3mL水;③lmL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )
 在3支试管中分别装有:①lmL苯和3mL水:②lmLCCl4和3mL水;③lmL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )
在3支试管中分别装有:①lmL苯和3mL水:②lmLCCl4和3mL水;③lmL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )| A. | ①②③ | B. | ①③② | C. | ③②① | D. | ②③① |
9.下列说法正确的是( )
| A. | 标准状况下,22.4L H2和O2的混合物所含分子数为NA | |
| B. | 标准状况下,18g H2O的体积是22.4L | |
| C. | 在常温常压下,11.2L N2含有的分子数为0.5NA | |
| D. | 1mol SO2的体积是22.4L |
6.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.76 kJ•mol-1 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1 451.52 kJ•mol-1 | |
| C. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-725.76 kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 451.52 kJ•mol-1 |
13.已知N2+3H2?2NH3为放热反应,对该反应的下列说法中正确的是( )
| A. | N2的能量一定高于NH3 | |
| B. | H2的能量一定高于NH3 | |
| C. | 1 mol N2和3 mol H2的总能量一定高于2 mol NH3的总能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
3.1mol某烃在氧气中燃烧,需要氧气212.8L(标准状况).进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是( )
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)3CHCH2CH(CH3)3 | D. | (CH3)3CCH2CH3 |
10.下列化合物的同类同分异构体数目为5种的是(不考虑立体异构)( )
| A. | 己烷C6H14 | B. | 戊醛C5H10O | C. | 丙醇C3H8O | D. | 一氯戊烷C5H12Cl |
7.下列化合物分子中的所有碳原子不可能处于同一平面的是( )
| A. | 硝基苯 | B. | 异丁烷 | C. | 苯 | D. | CH3-CH=CH-CH3 |
8. KIO2是食用碘盐的添加剂,工业上制取KIO2的方法之一如图所示,其中阳(阴)离子隔膜只允许阳(阴)离子通过,下列有关说法中正确的是( )
KIO2是食用碘盐的添加剂,工业上制取KIO2的方法之一如图所示,其中阳(阴)离子隔膜只允许阳(阴)离子通过,下列有关说法中正确的是( )
 KIO2是食用碘盐的添加剂,工业上制取KIO2的方法之一如图所示,其中阳(阴)离子隔膜只允许阳(阴)离子通过,下列有关说法中正确的是( )
KIO2是食用碘盐的添加剂,工业上制取KIO2的方法之一如图所示,其中阳(阴)离子隔膜只允许阳(阴)离子通过,下列有关说法中正确的是( )| A. | 可用铁作阳极、石墨作阴极 | |
| B. | 装置中的隔膜为阳离子隔膜 | |
| C. | 当外电路中通过2 mole-时,阴极上会有22.4LH2生成 | |
| D. | 阳极电极反应式为:I--6e-+6OH-=IO2-+3H2O |