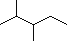
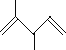
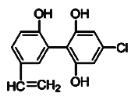
题目内容
【题目】如图,是实验室制备乙酸乙酯的装置。a试管中加入3mL95%的乙醇、2mL浓硫酸、2mL冰醋酸;b试管中是饱和碳酸钠溶液。连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
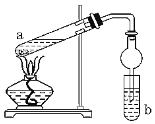
(1)在a试管中除了加入乙醇、浓硫酸和乙酸外,还应放入__,目的是__。
(2)试管b中观察到的主要现象是__。
(3)实验中球形干燥管除起冷凝作用外,另一个重要作用是__。
(4)饱和Na2CO3溶液的作用是__。
(5)反应结束后,将试管中收集到的产品倒入分液漏斗中,__、__,然后分液,得到乙酸乙酯。
【答案】沸石(或碎瓷片) 防止暴沸 溶液分层,在饱和碳酸钠上层产生有特殊香味的无色液体 防倒吸 除去乙酸和乙醇,降低乙酸乙酯的溶解度有利于分层 振荡 静置
【解析】
乙醇、乙酸在浓硫酸作催化剂并加热的条件下发生取代反应,由于物全部为液体,加热时反应比较剧烈,加入沸石以防暴沸,反应后生成的乙酸乙酯用饱和碳酸钠溶液接收,除去产品中的乙醇、乙酸等杂质,最后经分液得到纯净的乙酸乙酯。
(1)加热前,a试管中需要加入沸石或碎瓷片,目的是为了防止暴沸,答案为:沸石(或碎瓷片);防止暴沸;
(2) 碳酸钠溶液能溶解乙醇、与乙酸反应,乙酸乙酯密度小且不溶于饱和碳酸钠溶液,试管b中液体会出现分层现象,上层为有特殊香味的无色液体,答案为:溶液分层,在饱和碳酸钠上层产生有特殊香味的无色液体;
(3) 酸钠溶液能溶解乙醇、与乙酸反应,使压强减小,容易产生倒吸,所以实验中球形干燥管除起冷凝作用外,另一个重要作用是防止倒吸,答案为:防倒吸;
(4)碳酸钠溶液中的水溶解乙醇,碳酸钠能跟乙酸反应吸收乙酸,同时可以降低乙酸乙酯的溶解度,使乙酸乙酯难溶于饱和碳酸钠溶液,便于分层,答案为:除去乙酸和乙醇,降低乙酸乙酯的溶解度有利于分层;
(5)乙酸乙酯的密度比水小,制得的乙酸乙酯与碳酸钠溶液分层,且处于碳酸钠溶液的上层,因此分离的方法为分液,即将产品倒入分液漏斗中,充分振荡除杂,静置合之分层,然后分液,得到乙酸乙酯,答案为:振荡;静置。

【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
I.CO2可以被NaOH溶液捕获,若所得溶液c(HCO3-)∶c(CO32-)=2∶1,溶液pH=_____。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
II.CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
(1)已知上述反应中相关的化学键键能数据:
化学键 | C-H | C=O | H-H |
|
键能/kJ/mol | 413 | 745 | 436 | 1075 |
则该反应的ΔH=___________。分别在V L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___________(填“A”或“B”)。
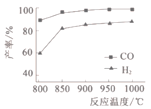
(2)按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图1所示。此反应优选温度为900℃的原因是____________。
(3)在T1温度时,将CH4和CO2各1.0 mol充入2 L密闭恒容容器中,充分反应达到平衡后,若CH4转化率为40%,则
①容器内的压强与起始压强之比为___________;
②此温度下,若该容器中含有CH4、CO2、H2、CO各1.0 mol,则此时反应所处的状态为___________(填“向正反应方向进行中”“向逆反应方向进行中”或“平衡状态”)
③欲使甲烷的平衡转化率提高,应采取的措施是___________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强