题目内容
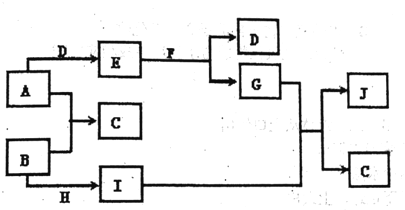
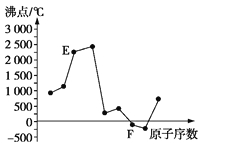
【题目】A、B、C、D、E、F是原子序数依次增大的短周期元素。A、B可分别与C组成常见化合物AC、AC2、BC、BC2; 6种元素中原子半径最大的是D元素;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续)。下列判断与说法正确的是
A.元素C、D、F的原子半径由小到大的顺序为F<C<D
B.元素B、E形成的化合物具有类似金刚石的结构,熔点高,硬度大,所以在该化合物中B、E之间存在的是共价键
C.元素A、B、F的最高价氧化物对应的水化物均属于强酸,且元素F的含氧酸具有强氧化性
D.元素C、D、E所组成化合物的水溶液呈碱性,若加入元素E、F所组成化合物的水溶液,会有白色沉淀析出,同时产生大量气体
【答案】B
【解析】本题考查元素周期律,周期表的结构与特点等,意在考查考生对化学基本理论的了解以及考生的推理与判断能力。由题给信息可推知,A为碳元素,B为氮元素,C为氧元素,D为钠元素,E为铝元素,F为氯元素。A项,原子半径:Na>Cl>O,错误;B项,铝与氮形成的AlN为原子晶体,故其晶体中原子是依靠共价键结合,正确;C项,H2CO3为弱酸,错误;D项,NaAlO2与AlCl3反应会生成Al(OH)3沉淀,但无气体产生,错误。

【题目】某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。

学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:______。
为了验证可能为甲,请完成下列实验方案。限选试剂:
a.98%的浓硫酸 b.1%的品红溶液 c.1.0 mol·L-1的KI-淀粉溶液
d.1.0 mol·L-1 的NaOH溶液 e.澄清石灰水 f.饱和NaCl溶液
所加试剂 | 预期现象和结论 |
试管A中加足量______(填序号); 试管B中加1%品红溶液; 试管C中加______(填序号)。 | 若A中________, B中________, C中________,则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度。
①在使用滴定管之前首先进行的操作是_____________________;
②量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;(反应的化学方程式为:NaClO + Na2SO3 = NaCl+ Na2SO4)将b mol·L-1的用硫酸酸化的KMnO4溶液装入_________(填仪器名称)中;滴定剩余的Na2SO3溶液,反应的化学方程式为:_______________。当溶液由__________(填滴定终点现象)停止滴定,记录数据。
③重复上述滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为_______mol·L-1(用含a、b、v1、v2的代数式表示)。