题目内容
【题目】下列试剂的保存方法错误的是( )
A.实验室少量的钠保存在煤油中B.浓硝酸保存在无色细口玻璃瓶中
C.存放FeSO4溶液时加入少量铁粉D.NaOH溶液保存在橡皮塞的试剂瓶中
【答案】B
【解析】
A.钠密度大于煤油,与煤油不反应少量的钠保存在煤油中可以隔绝空气中氧气和水,故A正确;
B.浓硝酸见光易分解,应保存在棕色细口瓶中,故B错误;
C.亚铁离子容易被氧化,加入少量铁粉可以防止被氧化,故C正确;
D.氢氧化钠能够与二氧化硅反应生成硅酸钠,硅酸钠能够将玻璃塞和玻璃瓶粘在一起,所以盛放氢氧化钠溶液的试剂瓶不能使用玻璃塞,可以使用橡胶塞,故D正确;
故答案为B。

 全程金卷系列答案
全程金卷系列答案【题目】工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质。工业冶炼铜的化学方程式是:8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和____________。
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验。
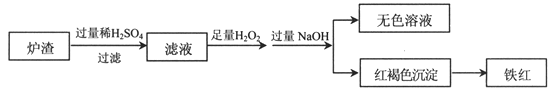
①滤液中的阳离子有Fe3+、Fe2+、H+、_____________。
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是____(填序号)。
实验方案 | 预期现象 | |
a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
c | 加酸性KMnO4溶液 | 紫色褪去 |
d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
③滤液在酸性条件下,与H2O2反应的离子方程式是_________________________。
(3)m克铝热剂(氧化铁与铝)恰好完全反应,则该反应中氧化产物与还原产物的质量比是________________________。