题目内容
在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
① 产生这些气体消耗的锌的质量是多少?② 通过导线的电子的物质的量是多少?
③ 原稀硫酸的物质的量浓度是多少?④ 若整个反应用时5分钟,则用H+表示该反应的平均速率为多少?
【答案】
① 9.75 g;② 0.3 mol;③ 0.75 mol/L ④ 0.3 mol?L-1?min-1
【解析】
试题分析:①铜片、锌片和稀硫酸组成的原电池中,金属锌为负极,电极反应为:Zn-2e-=Zn2+。金属铜为正极,电极反应为:2H++2e-=H2↑,当在铜片上放出3.36L(标准状况)即0.15mol的H2时,转移电子为0.3mol,在负极消耗金属锌为0.15mol,质量为0.15mol×65g/mol=9.75g。
③氢气的物质的量是0.15mol,则根据氢原子守恒可知,200mL稀硫酸中硫酸的物质的量为0.15mol,乙醇稀硫酸的物质的量浓度c=0.15mol÷0.2L=0.75mol/L。
④反应速率通常用单位时间内浓度的变化量来表示,则用H+表示该反应的平均速率=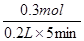 =0.3 mol?L-1?min-1。
=0.3 mol?L-1?min-1。
考点:考查原电池原理的有关判断、应用和计算
点评:该题是中等难度的试题,主要是考查学生对原电池原理的熟悉了解程度,有利于培养学生的规范答题能力。根据原电池的工作原理书写电极反应并根据电极反应进行计算是考试的热点,需要重点掌握并能灵活运用。

练习册系列答案
相关题目