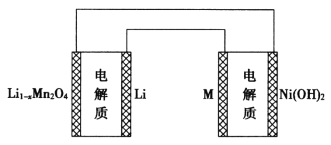
题目内容
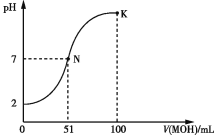
【题目】常温下,向100 mL 0.1 mol·L-1 HA溶液中逐滴加入0.2 mol·L-1 MOH溶液,所得溶液的pH变化曲线如图所示。下列有关说法正确的是 ( )
A.HA的电离方程式:HA![]() H++A-
H++A-
B.N点、K点水的电离程度:N<K
C.N点溶液中:c(A-)=c(M+)=c(H+)=c(OH-)
D.K点溶液中:c(OH-)+c(MOH)+c(A-)-c(H+)=0.1 mol·L-1
【答案】D
【解析】
分析图像中的pH变化曲线,起始时溶液的pH值为2,说明HA酸为一元弱酸,当加入50mL时,两者恰好完全反应,此时溶液的pH值小于7,说明碱是一元弱碱。
A.HA酸为一元弱酸,其电离方程式要用可逆符号,不可以用等号,故A选项错误。
B.N点时溶液为中性,K点时碱过量较多,碱能抑制水的电离,故电离程度N>K,故B选项错误。
C.根据N点溶液中的电荷守恒,可得出:c(A - )= c(M + )> c(OH - )= c(H + ),故C选项错误。
D.K点时溶液中的电荷守恒,可得出:c(A - )+ c(OH - )= c(H + )+ c(M + ),溶液中物料守恒可得c(MOH)+c(M + )= 0.1mol/L,联立消去c(M+)可得c(OH-)+c(MOH)+c(A-)-c(H+)=0.1 mol·L-1,故D选项正确。
故答案选D。

【题目】气体的自动化检测中常常应用根据原电池原理设计的传感器。下图为电池的工作示意图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。
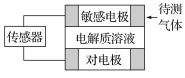
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是
A. 上述气体检测时,敏感电极均作电池负极
B. 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-===2Cl-
C. 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-
D. 检测Cl2和CO体积分数相同的两份空气样本时,传感器上电流大小、方向相同