��Ŀ����
ʯ�ͻ����ǽ���ʡ��֧����ҵ֮һ��������ϩ����;ʮ�ֹ㷺��ʯ�ͻ�����Ʒ��ij���������������й�������������ϩ�ĵ�������ϩ��CH2=CH2+Cl2��CH2Cl��CH2Cl��
CH2Cl��CH2Cl��CH2=CHCl+HCl��
������������⣺
��1����֪��Ӧ���ж�������IJ��ʣ�![]() ��Ϊ98%����Ӧ��������ϩ���Ȼ���IJ��ʾ�Ϊ95%����2.8 t��ϩ���Ƶ�����ϩ___________t��ͬʱ�õ��������Ȼ���__________t��������������1λС����
��Ϊ98%����Ӧ��������ϩ���Ȼ���IJ��ʾ�Ϊ95%����2.8 t��ϩ���Ƶ�����ϩ___________t��ͬʱ�õ��������Ȼ���__________t��������������1λС����
��2��Ϊ������ø������Ȼ��⣬�ù������������з�Ӧ������������
2CH2=CH2+4HCl+O2��2CH2Cl��CH2Cl+2H2O��
�ɷ�Ӧ�٢ۻ�ö������飬�ٽ���������ͨ����Ӧ�ڵõ�����ϩ�������Ȼ��⣬�������Ȼ����Ӧ��ʹ�ã��γ����µĹ��ա�
���ڸ���Ӧ�Ĵ��ڣ�������Ͷ�����ϩȫ��������ʱ����Ӧ�٢��ж�������IJ�������Ϊa%��c%����������ȫ��������ʱ����Ӧ�����Ȼ���IJ���Ϊb%���Լ��㣺��Ӧ�٢�����ϩ��Ͷ�ϱ�Ϊ����ʱ���¹��ռȲ���Ҫ�����Ȼ���Ϊԭ�ϣ���û�и������Ȼ���ʣ�ࣨ�����ڷ����ĸ���Ӧ�мȲ������Ȼ��⣬Ҳ�������Ȼ��⣩��
�����������Ƕಽ��Ӧ�ļ����⣬����Ĺؼ����ҵ���ȷ�Ĺ�ϵʽ�������ϵ����1����2.8t��ϩ���Ƶ�����ϩ������Ϊm1���Ƶ�HCl������Ϊm2��
�ɷ���ʽ�٢ڵù�ϵʽ��
CH2=CH2��CH2=CHCl��HCl
2.8t 62.5t 36.5t
2.8t��98%��95% m1 m2
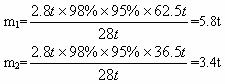
(2)�������¹��ռ�����Ҫ����HClΪԭ�ϣ���Ϊ����ƷHClʣ�ࡱ��Ӧ������HCl�����ʵ����뷴Ӧ������HCl��ȡ�����Ӧ������HCl�����ʵ������ɷ�Ӧ�٢��Ƶ�һ������������ʵ�����ã���Ӧ�����ĵ�HCl�����ʵ������ɷ�Ӧ�����ĵ���ϩ������ã�ͬ��������������ϵ������⡣
�𰸣���1��5.8��3.4
��2����Ͷ�뷴Ӧ�٢۵���ϩ���ʵ����ֱ�Ϊx��y����
�ɷ�Ӧ�����ɵĶ�������Ϊx��a%��
�ɷ�Ӧ�����ɵĶ�������Ϊy��c%
���ɷ�Ӧ�٢۹��Ƶö�����������ʵ���Ϊ��x��a%+y��c%����ͨ����Ӧ�ڿɻ��HCl�����ʵ���Ϊ����x��a%+y��c%����b%��
�����⣬��Ӧ�����ĵ�HClΪ2��y��c%����
2��y��c������x��a%+y��c%����b%
��ã�![]() ����Ӧ�٢�����ϩ��Ͷ�ϱ�ӦΪ
����Ӧ�٢�����ϩ��Ͷ�ϱ�ӦΪ![]() ��
��

 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� ��100%)Ϊ98%����Ӧ��������ϩ���Ȼ���IJ��ʾ�Ϊ95%����2.8 t��ϩ���Ƶ�����ϩ__________t��ͬʱ�õ��������Ȼ���__________t��(����������1λС��)
��100%)Ϊ98%����Ӧ��������ϩ���Ȼ���IJ��ʾ�Ϊ95%����2.8 t��ϩ���Ƶ�����ϩ__________t��ͬʱ�õ��������Ȼ���__________t��(����������1λС��)