题目内容
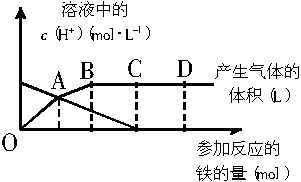
铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知在与冷稀HNO3反应时,主要还原产物为NO气体;在与热的稀HNO3作用时,主要还原产物为N2O气体;当HNO3更稀时,其重要还原产物是![]() 。现有铁与稀HNO3作用,请分析下图,完成有关问题。
。现有铁与稀HNO3作用,请分析下图,完成有关问题。

假设曲线的各段内只有一种还原产物。
(1)0点到a点的还原产物是_________。
(2)a点到b点的还原产物是_________,其原因是__________________________________。
(3)试完成b点到c点的反应方程式:
![]() Fe+
Fe+![]() HNO3——
HNO3——![]() Fe(NO3)3+
Fe(NO3)3+![]()
![]() +
+![]() H2O
H2O
(4)反应过程中,到达__________点时HNO3已完全反应。
(5)已知达到d点时,反应结束,此时溶液中的主要阳离子是__________。
(6)c点和d点参加反应的铁的物质的量之比是__________。
解析:根据图形,应先对气体体积曲线和溶液中[H+]变化曲线作出正确判断。溶液中的[H+]逐渐减小,至c点为0,说明HNO3逐渐参与反应,到c点时恰好反应完全,即0点到c点是铁与HNO3的反应,c点到d点是生成的Fe(NO3)3与铁的反应,到d点时,溶液中生成的Fe(NO3)3完全反应,全部转化为Fe(NO3)2;搞清了[H+]浓度的变化曲线,也就不难理解气体曲线了,只要抓住题目中的已知和铁用量、转移电子数、产生NO或N2O体积的多少的关系及曲线斜率,就不难断定其主要还原产物了。oa:NO,ab:N2O;bc:NH4NO3;cd;Fe(NO3)2。计算c、d点参加反应的铁的物质的量之比时,要明确是0到c铁与HNO3反应生成的Fe(NO3)3,由2Fe(NO3)3+Fe![]() 3Fe(NO3)2可知:生成的Fe(NO3)3的物质的量是cd段“Fe”物质的量的2倍,所以oc段参加反应的铁量是cd段的2倍,这也是本题的巧点。
3Fe(NO3)2可知:生成的Fe(NO3)3的物质的量是cd段“Fe”物质的量的2倍,所以oc段参加反应的铁量是cd段的2倍,这也是本题的巧点。
答案:(1)NO (2)N2O 反应放热,使溶液温度升高 (3)8 30 8 3NH4NO3 9 (4)c (5)Fe2+(6)2∶3

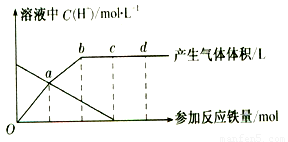
 。现有铁与稀HNO3反应的关系图(如图所示),
。现有铁与稀HNO3反应的关系图(如图所示),