题目内容
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是( )
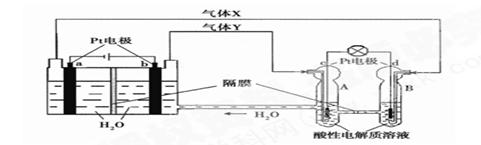
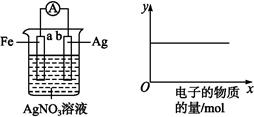
A.当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B.b极上发生的电极反应是:4H2O + 4e- = 2H2↑+ 4OH-
C.d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A

A.当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B.b极上发生的电极反应是:4H2O + 4e- = 2H2↑+ 4OH-
C.d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
D
试题分析:由题给装置图可知,左边装置有外加电源,为电解池,右边装置是原电池。电解池中,b电极与外加电源的正极相连,则b为阳极,失电子发生氧化反应:4OH--4e-═2H2O+O2↑;a电极与外加电源的负极相连,则a为阴极,得到电子发生还原反应:2H++2e-═H2↑;燃料电池中是酸性溶液,结合装置图知,d为负极失电子发生氧化反应:H2-2e-═2H+;c电极为正极得到电子发生还原反应:O2+4H++4e-═2H2O。A、根据上述分析知,当有0.1mol电子转移时,a极产生1.12L H2(标准状况下),错误;B、 b极上发生的电极反应是:4OH--4e-═2H2O+O2↑,错误;C、 d极上发生的电极反应是:H2-2e-═2H+,错误;D、c为原电池的正极,阳离子移向正极, c极上进行还原反应,B中的H+可以通过隔膜进入A,正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

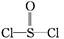 )中而形成的,电池总反应方程式为:8Li+3SOCl2
)中而形成的,电池总反应方程式为:8Li+3SOCl2 6LiCl+Li2SO3+2S,下列叙述中正确的是( )
6LiCl+Li2SO3+2S,下列叙述中正确的是( )