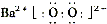题目内容
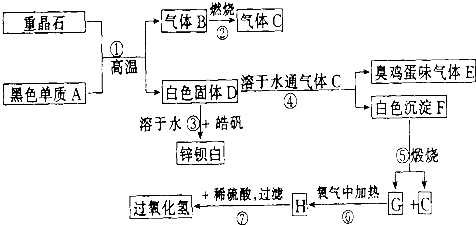
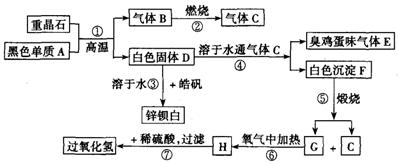
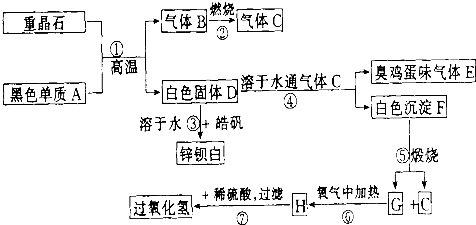
硫酸钡是惟一无毒的钡盐,工业上以BaSO4等为原料通入下列流程反应可以制备锌钡白和过氧化氢:

(1)上述流程中共有7个化学反应,其中______(填编号)属于氧化还原反应.
(2)写出物质H的电子式______.
(3)写出下列化学反应方程式:
反应①:______.反应③:______.反应④:______.反应⑦:______.
解:(1)流程中7个化学反应,反应①BaSO4+4C=BaS+4CO↑,碳元素的化合价由0价升高为+2价,硫元素化合价由+6价降低为-2价,属于氧化还原反应;反应②是CO的燃烧,碳元素、氧元素化合价发生变化,属于氧化还原反应;反应③BaS+ZnSO4=ZnS↓+BaSO4↓,各元素化合价未发生变化,属于复分解反应;反应④BaS+H2O+CO2=BaCO3↓+H2S,各元素化合价未发生变化,属于复分解反应;反应⑤为BaCO3 Ba+CO2↑,各元素化合价未发生变化,属于分解反应;反应⑥为2BaO+O2
Ba+CO2↑,各元素化合价未发生变化,属于分解反应;反应⑥为2BaO+O2 2BaO2,氧元素化合价发生变化,属于氧化还原反应;反应⑦BaO2+H2SO4=BaSO4↓+H2O2,各元素化合价未发生变化,属于复分解反应.所以7个反应中①②⑥属于氧化还原反应.
2BaO2,氧元素化合价发生变化,属于氧化还原反应;反应⑦BaO2+H2SO4=BaSO4↓+H2O2,各元素化合价未发生变化,属于复分解反应.所以7个反应中①②⑥属于氧化还原反应.
故答案为:①②⑥.
(2)H是BaO2,属于离子化合物,由钡离子与过氧根离子构成,电子式为 .
.
故答案为: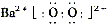 .
.
(3)由分析可知,反应①:BaSO4+4C BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.
BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.
反应④:BaS+H2O+CO2=BaCO3↓+H2S.反应⑦:BaO2+H2SO4=BaSO4↓+H2O2.
故答案为:①:BaSO4+4C BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.
BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.
反应④:BaS+H2O+CO2=BaCO3↓+H2S.反应⑦:BaO2+H2SO4=BaSO4↓+H2O2.
分析:重晶石是BaSO4,黑色单质A通常是碳.由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2.有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-.BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS.BaS溶于H2O,与皓矾(ZnSO4?7H2O)反应生成锌钡白(BaSO4和BaS的混合物).BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3.进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2.
(1)元素化合价在反应前后发生变化的反应属于氧化还原反应.
(2)BaO2,属于离子化合物,由钡离子与过氧根离子构成.
(3)根据上述分析可知各反应中反应物与产物,配平书写方程式.
点评:以制备锌钡白和过氧化氢为载体,考查物质推断、氧化还原反应、化学用语等,难度中等.是对所学知识的综合运用与能力的考查,根据已有知识结合工艺流程推断物质及发生反应是解题关键.
 Ba+CO2↑,各元素化合价未发生变化,属于分解反应;反应⑥为2BaO+O2
Ba+CO2↑,各元素化合价未发生变化,属于分解反应;反应⑥为2BaO+O2 2BaO2,氧元素化合价发生变化,属于氧化还原反应;反应⑦BaO2+H2SO4=BaSO4↓+H2O2,各元素化合价未发生变化,属于复分解反应.所以7个反应中①②⑥属于氧化还原反应.
2BaO2,氧元素化合价发生变化,属于氧化还原反应;反应⑦BaO2+H2SO4=BaSO4↓+H2O2,各元素化合价未发生变化,属于复分解反应.所以7个反应中①②⑥属于氧化还原反应.故答案为:①②⑥.
(2)H是BaO2,属于离子化合物,由钡离子与过氧根离子构成,电子式为
 .
.故答案为:
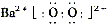 .
.(3)由分析可知,反应①:BaSO4+4C
 BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.
BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.反应④:BaS+H2O+CO2=BaCO3↓+H2S.反应⑦:BaO2+H2SO4=BaSO4↓+H2O2.
故答案为:①:BaSO4+4C
 BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.
BaS+4CO↑.反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.反应④:BaS+H2O+CO2=BaCO3↓+H2S.反应⑦:BaO2+H2SO4=BaSO4↓+H2O2.
分析:重晶石是BaSO4,黑色单质A通常是碳.由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2.有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-.BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS.BaS溶于H2O,与皓矾(ZnSO4?7H2O)反应生成锌钡白(BaSO4和BaS的混合物).BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3.进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2.
(1)元素化合价在反应前后发生变化的反应属于氧化还原反应.
(2)BaO2,属于离子化合物,由钡离子与过氧根离子构成.
(3)根据上述分析可知各反应中反应物与产物,配平书写方程式.
点评:以制备锌钡白和过氧化氢为载体,考查物质推断、氧化还原反应、化学用语等,难度中等.是对所学知识的综合运用与能力的考查,根据已有知识结合工艺流程推断物质及发生反应是解题关键.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目