题目内容
某研究小组测定菠菜中草酸及草酸盐含量(以C2O42-计),实验步骤如下:
①将菠菜样品预处理后,热水浸泡,过滤得到含有草酸及草酸盐的溶液.
②调节溶液的酸碱性,滴加足量CaCl2溶液,产生白色沉淀;加入足量醋酸,使CaCO3溶解;过滤得到CaC2O4固体.
③用稀HCl溶解CaC2O4,并加水配制成100mL溶液.每次准确移取取25.00mL该溶液,用0.0100mol?L-1KMnO4标准溶液滴定,平均消耗标准溶液VmL.
回答下列问题:
(1)步骤①中“样品预处理”的方法是______.(A.灼烧成灰 B.研磨成汁)
(2)步骤②中“调节溶液的酸碱性”至______.(A.弱碱性 B.弱酸性 C.中性)验证CaCl2溶液已“足量”的操作和现象是:______
(3)步骤③中用到的玻璃仪器除烧杯、锥形瓶、胶头滴管、玻璃棒外,还有______.
(4)经计算,该菠菜样品中C2O42-的总物质的量为______,若样品的质量为mg,则菠菜中草酸及草酸盐(以C2O42-计)的质量分数为______,(已知:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,C2O42-的摩尔质量为88g?mol-1)
解:(1)波菜不能燃烧,不能将之化为灰烬,可以采用研磨成汁的方法,故答案为:B;
(2)在酸性环境下,草酸根离子可以和氢离子反应生成草酸弱电解质,影响草酸根的检验,可以选择碱性或是中性环境,CaCl2溶液已“足量”,则草酸根离子会全部沉淀下来,只要证明草酸根离子不存在即可,即静置,待上层溶液澄清后滴入CaCl2溶液,不出现浑浊,故答案为:A(或C);静置,待上层溶液澄清后滴入CaCl2溶液,不出现浑浊;
(3)用稀HCl溶解CaC2O4,并加水配制成100mL溶液,需要100mL的容量瓶,0.0100mol?L-1KMnO4标准溶液滴定时,高锰酸钾必须放在酸式滴定管中,
故答案为:酸式滴定管、100mL容量瓶(或多填“移液管”);
(4)设菠菜样品中C2O42-的总物质的量为n,则根据2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,得
2MnO4-~5C2O42-
2 5
0.0100mol?L-1×V×10-3L n
 ,
,
解得n=2.5V×10-3mol,
所以该菠菜样品中C2O42-的总物质的量为2.5V×10-3mol× =V×10-4 mol,
=V×10-4 mol,
菠菜中草酸及草酸盐(以C2O42-计)的质量分数为 ×100%=
×100%=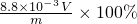 ,
,
故答案为:V×10-4mol;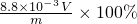 .
.
分析:(1)根据波菜不能燃烧的知识来选择合适的方法;
(2)根据菠菜中含有草酸及草酸盐,标定草酸根的量可以确定菠菜中C2O42-的含量,在碱性环境下,草酸可以和碱发生中和反应;
(3)根据配置一定体积的溶液以及滴定实验所用仪器来回答;
(4)根据化学方程式进行计算.
点评:本题是物质检验试题,做这样的题目,要熟练掌握常见物质的检验、鉴定方法,能灵活运用知识迁移的方法.
(2)在酸性环境下,草酸根离子可以和氢离子反应生成草酸弱电解质,影响草酸根的检验,可以选择碱性或是中性环境,CaCl2溶液已“足量”,则草酸根离子会全部沉淀下来,只要证明草酸根离子不存在即可,即静置,待上层溶液澄清后滴入CaCl2溶液,不出现浑浊,故答案为:A(或C);静置,待上层溶液澄清后滴入CaCl2溶液,不出现浑浊;
(3)用稀HCl溶解CaC2O4,并加水配制成100mL溶液,需要100mL的容量瓶,0.0100mol?L-1KMnO4标准溶液滴定时,高锰酸钾必须放在酸式滴定管中,
故答案为:酸式滴定管、100mL容量瓶(或多填“移液管”);
(4)设菠菜样品中C2O42-的总物质的量为n,则根据2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,得
2MnO4-~5C2O42-
2 5
0.0100mol?L-1×V×10-3L n
 ,
,解得n=2.5V×10-3mol,
所以该菠菜样品中C2O42-的总物质的量为2.5V×10-3mol×
 =V×10-4 mol,
=V×10-4 mol,菠菜中草酸及草酸盐(以C2O42-计)的质量分数为
 ×100%=
×100%=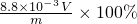 ,
,故答案为:V×10-4mol;
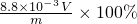 .
.分析:(1)根据波菜不能燃烧的知识来选择合适的方法;
(2)根据菠菜中含有草酸及草酸盐,标定草酸根的量可以确定菠菜中C2O42-的含量,在碱性环境下,草酸可以和碱发生中和反应;
(3)根据配置一定体积的溶液以及滴定实验所用仪器来回答;
(4)根据化学方程式进行计算.
点评:本题是物质检验试题,做这样的题目,要熟练掌握常见物质的检验、鉴定方法,能灵活运用知识迁移的方法.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 品预处理,得到含有草酸及草酸盐的溶液。
品预处理,得到含有草酸及草酸盐的溶液。