题目内容
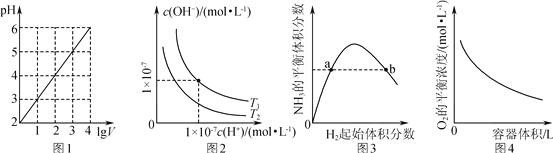
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法正确的是

A. Kb2的数量级为10-5
B. X(OH)NO3水溶液显酸性
C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]
D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)=c(X2+)+c(H+)
【答案】D
【解析】
A.选取图中点(6.2,0.5),此时pH=6.2,c[X(OH)+]= c(X2+ ), Kb2= c(OH- )![]() c(X2+ )/ c[X(OH)+]= c(OH- )=10-14-(-6.2)=10-7.8,故A错误;
c(X2+ )/ c[X(OH)+]= c(OH- )=10-14-(-6.2)=10-7.8,故A错误;
B.X(OH)NO3水溶液中X的主要存在形式为X(OH)+,由图示X(OH)+占主导位置时,pH为7到8之间,溶液显碱性,故B错误;
C.选取图中点(9.2,0.5),此时c[X(OH)2]=c[X(OH)+],溶液的pH=9.2,则X(OH)2的Kb1=c(OH-)×c[X(OH)+]/ c[X(OH)2]=10-4.8,X2+第一步水解平衡常数为Kh1=Kw/Kb2=10-6.2,第二步水解平衡常数Kh2=Kw/Kb1=10-9.2,由于Kh1>Kb2>Kh2,等物质的量的X(NO3)2和X(OH)NO3混合溶液中,X2+的水解大于X(OH)+的电离,溶液显酸性,所以此时c(X2+ )<c[X(OH)+],故C错误;
D.在X(OH)NO3水溶液中,有电荷守恒c(NO3-) +c(OH-) = 2c(X2+) +c(H+)+c[X(OH)]+ ,物料守恒c(NO3- )=c(X2+ )+c[X(OH)2]+c[X(OH)]+,将物料守恒带入电荷守恒,将硝酸根离子的浓度消去,得到该溶液的质子守恒式为:c[X(OH)2]+c(OH- )=c(X2+ )+c(H+),故D正确;
答案:D。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】某学习小组利用下图装置探究铜与浓H2SO4的反应(夹持装置和A中加热装置已略,气密性已检验)。
资料:微量Cu2+与过量NaOH溶液发生反应:Cu2++4OH =[Cu(OH)4]2,[Cu(OH)4]2溶于甘油形成特征的绛蓝色溶液。

编号 | 实验用品 | 实验现象 | |
I | 10mL 15mol/L 浓H2SO4溶液 | 过量铜片 | 剧烈反应,品红溶液褪色,150℃时铜片表面产生大量黑色沉淀,继续加热,250℃时黑色沉淀消失。 |
II | 10mL 15mol/L 浓H2SO4溶液 | 适量铜片 | 剧烈反应,品红溶液褪色,150℃时铜片表面产生少量黑色沉淀,继续加热,250℃时黑色沉淀消失。 |
(1)A中反应的化学方程式是________。
(2)将装置C补充完整并标明所用试剂________。
(3)实验I中,铜片表面的黑色沉淀可能含CuO、Cu2S或CuS。为探究黑色沉淀的成分,取出反应后的铜片,用水小心冲洗后,进行下列操作:
|
|
i. 黑色沉淀脱落,一段时间后,上层溶液呈无色。 | ii. 开始时,上层溶液呈无色,一段时间后,上层溶液呈淡蓝色。 |
甲认为通过上述两个实验证明黑色沉淀不含CuO,理由是________。
②乙同学认为仅通过颜色判断不能得出上述结论,理由是______。需要增加实验iii,说明黑色沉淀不含CuO,实验iii的操作和现象是_______。
(4)甲同学对黑色沉淀成分继续探究,补全实验方案:
编号 | 实验操作 | 实验现象 |
iv | 取洗净后的黑色沉淀,加入适量_____溶液,加热。 | 黑色沉淀全部溶解,试管上部出现红棕色气体,底部有淡黄色固体生成。 |
(5)用仪器分析黑色沉淀的成分,数据如下:
150℃取样 | 230℃取样 |
铜元素3.2g,硫元0.96g。 | 铜元素1.28g,硫元0.64g。 |
230℃时黑色沉淀的成分是__________。
(6)为探究黑色沉淀消失的原因,取230℃时的黑色沉淀,加入浓H2SO4,加热至250℃时,黑色沉淀溶解,有刺激性气味的气体生成,试管底部出现淡黄色固体,溶液变蓝。用化学方程式解释原因____。
(7)综合上述实验过程,说明Cu和浓H2SO4除发生主反应外,还发生着其他副反应,为了避免副反应的发生,Cu和浓H2SO4反应的实验方案是______。