题目内容
过量铁粉与稀硝酸反应的方程式为:3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O,
①标出电子转移的方向和数目______
②该反应的氧化剂是______,还原产物是______;
③标准状况下,当生成2.24LNO气体时,有______gFe参加反应,转移电子的物质的量为______,有______mol氧化剂被还原.
①标出电子转移的方向和数目______
②该反应的氧化剂是______,还原产物是______;
③标准状况下,当生成2.24LNO气体时,有______gFe参加反应,转移电子的物质的量为______,有______mol氧化剂被还原.
①Fe元素的化合价由0升高为+2价,硝酸中N元素的化合价由+5价降低为+2价,该反应中3molFe反应生成6mol电子,则电子转移方向和数目为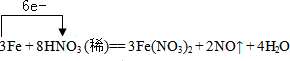 ,
,
故答案为: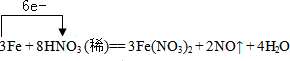 ;
;
②N元素的化合价降低,则HNO3为氧化剂,还原产物为NO,故答案为:HNO3;NO;
③标准状况下,当生成2.24LNO气体时,其物质的量为0.1mol,转移0.2mol×(5-2)=0.3mol电子,由N原子守恒可知,0.1mol氧化剂被还原,参加反应的Fe我0.1mol×
×56g/mol=8.4g,故答案为:8.4;0.3mol;0.1.
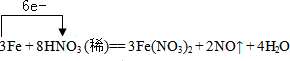 ,
,故答案为:
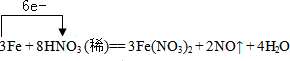 ;
;②N元素的化合价降低,则HNO3为氧化剂,还原产物为NO,故答案为:HNO3;NO;
③标准状况下,当生成2.24LNO气体时,其物质的量为0.1mol,转移0.2mol×(5-2)=0.3mol电子,由N原子守恒可知,0.1mol氧化剂被还原,参加反应的Fe我0.1mol×
| 3 |
| 2 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目