题目内容
【题目】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H.其中B是地壳中含量最多的金属元素.它们之间能发生如下反应(图中部分反应产物和反应条件没有全部标出). 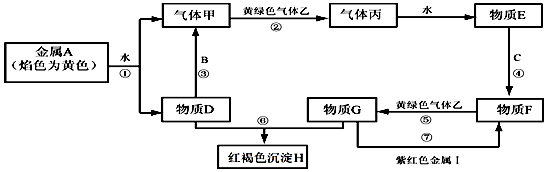
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:H、I;
(2)写出反应③的化学方程式:; 写出反应⑤的离子方程式:;写出反应⑦的离子方程式: .
【答案】
(1)Fe(OH)3; Cu
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑; Cl2+2Fe2+=2Cl﹣+2Fe3+; Cu+2Fe3+=Cu2++2Fe2+
【解析】解:(1)由以上分析可知H为Fe(OH)3,I为Cu,所以答案是:Fe(OH)3、Cu;(2)反应③的化学方程式:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,反应⑤为氯气和亚铁离子的反应,离子方程式为Cl2+2Fe2+=2Cl﹣+2Fe3+,反应⑦为铁离子与铜的反应,离子方程式为Cu+2Fe3+=Cu2++2Fe2+,
所以答案是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Cl2+2Fe2+=2Cl﹣+2Fe3+;Cu+2Fe3+=Cu2++2Fe2+.

练习册系列答案
相关题目
【题目】表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )
选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
B | Na | Na2O2 | NaCl | ②加H2O |
C | NO | NO2 | HNO3 | ③与C加热 |
D | Al2O3 | NaAlO2 | Al(OH)3 | ④与NaOH |
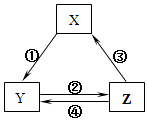
A.A
B.B
C.C
D.D

