题目内容
在其他条件不变时,纯净水中加入下列物质,不会影响水的电离平衡的是( )
| A.FeCl3 | B.NaOH | C.H2SO4 | D.NaNO3 |
水的电离平衡为:H2O?H++OH-,
A、加入氯化铁,铁离子结合水电离的氢氧根离子,水的电离平衡向着正向移动,促进了水的电离,故A错误;
B、加入氢氧化钠,氢氧根离子浓度增大,水的电离平衡向着逆向移动,抑制了水的电离,故B错误;
C、加入硫酸,溶液中氢离子浓度增大,水的电离平衡向着逆向移动,抑制了水的电离,故C错误;
D、加入硝酸钠,硝酸根离子和钠离子都不水解,对水的电离不产生影响,故D正确;
故选D.
A、加入氯化铁,铁离子结合水电离的氢氧根离子,水的电离平衡向着正向移动,促进了水的电离,故A错误;
B、加入氢氧化钠,氢氧根离子浓度增大,水的电离平衡向着逆向移动,抑制了水的电离,故B错误;
C、加入硫酸,溶液中氢离子浓度增大,水的电离平衡向着逆向移动,抑制了水的电离,故C错误;
D、加入硝酸钠,硝酸根离子和钠离子都不水解,对水的电离不产生影响,故D正确;
故选D.

练习册系列答案
相关题目
 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
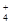 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH )-c(NH
)-c(NH