题目内容
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则下列说法中正确的是 ( )
| A.原子半径:丙>乙>丁 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
D
试题分析:甲、乙、丙、丁四元素分别为:H、N、Na、Al。则四者的原子半径为:Na>Al>N>H;A选项不正确;单质的还原性:Na>Al>H2;B选项不正确;C选项丙的氧化物可能为Na2O或者Na2O2,都属于离子化合物,所以不正确,;D选项乙、丙、丁的最高价氧化物对应的水化物分别是HNO3、NaOH、Al(OH)3,NaOH是强碱,Al(OH)3是两性氢氧化物,HNO3是强酸。故它们的最高价氧化物对应的水化物能相互反应。正确。

练习册系列答案
相关题目
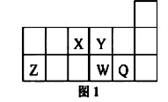

 Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。