题目内容
把100g浓度为18mol?L-1、密度为ρ的浓硫酸加到一定量的水中稀释成9mol?L-1的硫酸,则加入水的体积( )A.小于100mL
B.等于100mL
C.大于100mL
D.等于100/ρmL
【答案】分析:根据稀释前后溶质的质量不变来列式计算及硫酸的浓度越大,密度越大,w越大来分析,注意水的密度与硫酸的密度小.
解答:解:稀释前后溶质的质量不变,设加水的质量为x,
则100g×w1=(100g+x)×w2,
18mol?L-1的浓硫酸加到一定量的水中稀释成9mol?L-1的硫酸,
由c= 及硫酸的浓度越大,密度越大,
及硫酸的浓度越大,密度越大,
则w1>w2,w1<2w2,
所以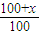 <2,
<2,
解得x<100g,
又水的密度约为1g/mL,
则加水的体积小于100mL,
故选A.
点评:本题考查物质的量浓度的计算,难度较大,学生容易忽略密度与浓度、质量分数的关系,水的密度与硫酸的密度大小.
解答:解:稀释前后溶质的质量不变,设加水的质量为x,
则100g×w1=(100g+x)×w2,
18mol?L-1的浓硫酸加到一定量的水中稀释成9mol?L-1的硫酸,
由c=
 及硫酸的浓度越大,密度越大,
及硫酸的浓度越大,密度越大,则w1>w2,w1<2w2,
所以
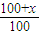 <2,
<2,解得x<100g,
又水的密度约为1g/mL,
则加水的体积小于100mL,
故选A.
点评:本题考查物质的量浓度的计算,难度较大,学生容易忽略密度与浓度、质量分数的关系,水的密度与硫酸的密度大小.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目