题目内容
常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是


| A.HA是强酸 |
| B.该混合液pH=7 |
| C.图中x表示HA,Y表示OH-,Z表示H+ |
| D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
D
试题分析:A、0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,得到的溶液为0.1mol/L的NaA溶液,若HA为强酸,则溶液为中性,且c(A-)=0.1mol/L,与图不符,所以HA为弱酸,A错误;B、根据A的分析,可知该溶液的pH>7,错误;C、A-水解使溶液显碱性,所以溶液中的粒子浓度的大小关系是c(Na+)> c(A-)>c(OH-)>c(HA)> c(H+),所以X是OH-,Y是HA,Z表示H+,错误;D、根据元素守恒,有c(A-)+c(HA)=c(Na+),正确,答案选D。

练习册系列答案
相关题目
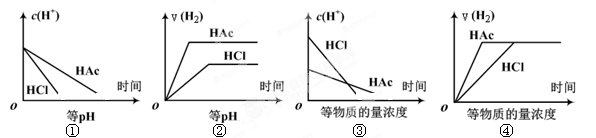
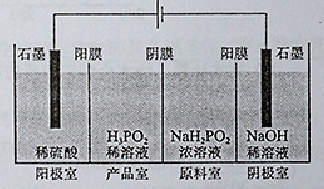
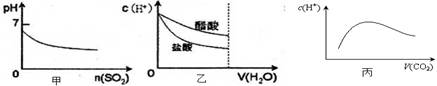
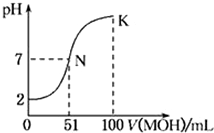
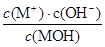 不变
不变 ?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是