题目内容
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
 2Z,其平衡常数为1600
2Z,其平衡常数为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
C
达平衡时X的转化率为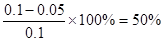 ,A正确;X的浓度变化量为:0.05 mol·L-1,Y的浓度变化量为:0.15 mol·L-1,Z的浓度变化量为:0.1 mol·L-1,三者浓度变化量之比=1:3:2,反应可表示为X+3Y?2Z,平衡常数
,A正确;X的浓度变化量为:0.05 mol·L-1,Y的浓度变化量为:0.15 mol·L-1,Z的浓度变化量为:0.1 mol·L-1,三者浓度变化量之比=1:3:2,反应可表示为X+3Y?2Z,平衡常数 ,B正确;增大压强使平衡向生成Z的方向移动,由于温度不变,所以平衡常数不变,C错;平衡常数受温度的变化而变化,D正确。
,B正确;增大压强使平衡向生成Z的方向移动,由于温度不变,所以平衡常数不变,C错;平衡常数受温度的变化而变化,D正确。
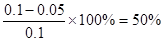 ,A正确;X的浓度变化量为:0.05 mol·L-1,Y的浓度变化量为:0.15 mol·L-1,Z的浓度变化量为:0.1 mol·L-1,三者浓度变化量之比=1:3:2,反应可表示为X+3Y?2Z,平衡常数
,A正确;X的浓度变化量为:0.05 mol·L-1,Y的浓度变化量为:0.15 mol·L-1,Z的浓度变化量为:0.1 mol·L-1,三者浓度变化量之比=1:3:2,反应可表示为X+3Y?2Z,平衡常数 ,B正确;增大压强使平衡向生成Z的方向移动,由于温度不变,所以平衡常数不变,C错;平衡常数受温度的变化而变化,D正确。
,B正确;增大压强使平衡向生成Z的方向移动,由于温度不变,所以平衡常数不变,C错;平衡常数受温度的变化而变化,D正确。
练习册系列答案
相关题目
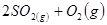

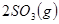 ,△H
,△H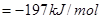 ,在相同温度下,向固定体积的密闭容器中通入
,在相同温度下,向固定体积的密闭容器中通入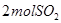 和
和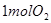 ,达到平衡时放出热量
,达到平衡时放出热量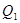 ;向另一个同体积的密闭容器中通入
;向另一个同体积的密闭容器中通入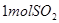 和
和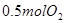 ,达到平衡时放出热量为
,达到平衡时放出热量为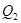 ,则下列关系中正确的是
,则下列关系中正确的是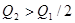
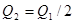
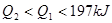

 2NH3(g);△H<0 。
2NH3(g);△H<0 。
 2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。